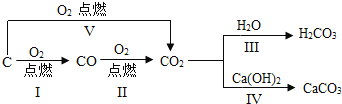
题目内容
【题目】试回答下列问题:
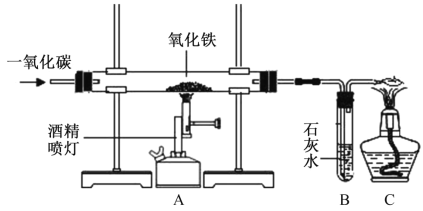
(1)实验中看到的实验现象为:玻璃管中的粉末______,试管里的澄淸石灰水______,用化学方程式表示石灰水发生这种变化的原因:____________。
(2)玻璃管中反应的化学方程式为_____________。
(3)加热氧化铁之前,先通一会儿一氧化碳的作用是_________。
(4)该实验设计装置C的目的是___________。
【答案】由红变黑 变浑浊 Ca(OH)2+CO2=CaCO3↓+H2O Fe2O3+3CO![]() 2Fe+3CO2 防止发生爆炸 防止一氧化碳污染空气
2Fe+3CO2 防止发生爆炸 防止一氧化碳污染空气
【解析】
(1)实验中可以看到玻璃管中的粉末由红变黑,故填由红变黑;
生成的二氧化碳使澄清的石灰水变浑浊,故填变浑浊;
石灰水变浑浊是二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水的缘故,故反应的化学方程式写为:Ca(OH)2+CO2=CaCO3↓+H2O。
(2)玻璃管中的反应是氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,故反应的化学方程式写为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(3)该实验开始进行时,应先通入一氧化碳,可以排净玻璃管内的空气,防止发生爆炸,故填防止发生爆炸。
(4)该实验的末端放一燃着的酒精灯可以燃烧掉尾气中的一氧化碳,防止一氧化碳污染空气,故填防止一氧化碳污染空气。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】硝酸钾的部分溶解度数据见下表。
温度(℃) | 10 | 20 | 40 | 60 |
溶解度(g/100g 水) | 20.9 | 31.6 | 63.9 | 110 |
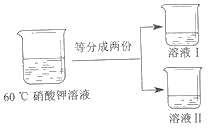
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A. 40-60 B. 20-40 C. 10-20 D. 低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。
【题目】对下列事实的微观解释正确的是![]()
![]()
选项 | 事实 | 解释 |
A | 体温计中的水银 | 分子间间隔随温度改变 |
B | 氧气能压缩在蓝色钢瓶中 | 氧分子大小随压强变大而减小 |
C | 金刚石、石墨性质存在明显差异 | 碳原子的排列方式不同 |
D | 氮气是无色的 | 氮分子是无色的 |
A. AB. BC. CD. D