题目内容
(1)盛装氢氧化?溶液的试剂瓶口会常会出现白色碳酸钠粉未,请用化学方程式表示其原理.如何证实白色粉未是碳酸钠而不是氢氧化钠?(2)工业上可用电解饱和食盐水的方法以来制取烧碱、氯气(Cl2)和氢气,则有关反应的化学方程式
(3)为测定某工业烧碱(含氯化钠杂质),某同学设计的实验步骤为:在天平的托盘上放大小相等的纸,称取10g烧碱样品;将烧碱样品放烧杯中,加入54g水溶解,并向其中滴入几滴酚酞试液;向烧杯中滴加质量分数为10%的稀盐酸,至二者恰好完全反应;用盐酸的量,计算出烧碱的纯度.据此,回答以下问题:
甲同学在步骤中的操作错误可能会使测定结果
(4)甲同学若按完全正确的操作进行实验,共消耗盐酸73g,请计算中步骤所得溶液中溶质的质量分数(写出计算过程).
分析:氢氧化钠能吸收空气中的二氧化碳生成碳酸钠,所以在瓶口处有碳酸钠粉末;由题干所给信息可以读出反应物与生成物及反应条件,可以写电解食盐水的化学方程式;根据烧碱的性质(烧碱是易潮解的物质)进行分析解答;氢氧化钠溶液和稀盐酸的质量和即为所得溶液的质量,根据溶质质量分数的计算公式可以计算出所得溶液中溶质的质量分数.
解答:解:(1)氢氧化钠能吸收空气中的二氧化碳,产生碳酸钠,所以只需证明有碳酸根就能说明氢氧化钠变质了就行了,所以可滴加盐酸来验证氢氧化钠是否变质;
(2)电解饱和食盐水生成氢气、氯气(Cl2)和烧碱:2NaCl+2H2O
2NaOH+Cl2↑+H2↑;
(3)因烧碱具有吸水性,称量时不能放在纸上称量,若放在纸上称量,氢氧化钠吸收的水分使纸湿润,从而会使部分氢氧化钠沾在纸上,所需盐酸的质量变少,从而使测定结果变少;在氢氧化钠与盐酸反应的过程中,当溶液恰好变为无色时,说明氢氧化钠与盐酸恰好完全反应;
(4)设氢氧化钠溶液中溶质的质量为x,生成氯化钠的质量为y
NaOH+HCl═NaCl+H2O
40 36.5 58.5
x 73g×10% y
=
x=8g
=
y=11.7g
原混合物氯化钠的质量为10g-8g=2g
m(NaCl)=11.7g+2g=13.7g
m(NaCl溶液)=10g+73g+54g=137g
NaCl%=
×100%=10%
答:略.
故答案为:(1)2NaOH+CO2═Na2CO3+H2O,将白色粉末加入盐酸,若有气泡产生则可证实有Na2CO3;
(2)2NaCl+2H2O
2NaOH+Cl2↑+H2↑;(3)偏小;溶液恰好由红色变为无色;(4)10%.
(2)电解饱和食盐水生成氢气、氯气(Cl2)和烧碱:2NaCl+2H2O
| ||
(3)因烧碱具有吸水性,称量时不能放在纸上称量,若放在纸上称量,氢氧化钠吸收的水分使纸湿润,从而会使部分氢氧化钠沾在纸上,所需盐酸的质量变少,从而使测定结果变少;在氢氧化钠与盐酸反应的过程中,当溶液恰好变为无色时,说明氢氧化钠与盐酸恰好完全反应;
(4)设氢氧化钠溶液中溶质的质量为x,生成氯化钠的质量为y
NaOH+HCl═NaCl+H2O
40 36.5 58.5
x 73g×10% y
| 40 |
| 36.5 |
| x |
| 73g×10% |
x=8g
| 36.5 |
| 58.5 |
| 73g×10% |
| y |
y=11.7g
原混合物氯化钠的质量为10g-8g=2g
m(NaCl)=11.7g+2g=13.7g
m(NaCl溶液)=10g+73g+54g=137g
NaCl%=
| 13.7g |
| 137g |
答:略.
故答案为:(1)2NaOH+CO2═Na2CO3+H2O,将白色粉末加入盐酸,若有气泡产生则可证实有Na2CO3;
(2)2NaCl+2H2O
| ||
点评:氢氧化钠在空气中易潮解,也能吸收空气中的二氧化碳,生成碳酸钠而变质.我们在检验是否变质时,只需检验有碳酸根即可.

练习册系列答案
相关题目
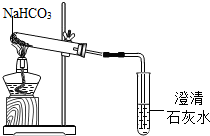 现象:试管口有水珠出现,澄清石灰水变浑浊.充分加热后,试管中留下白色固体.
现象:试管口有水珠出现,澄清石灰水变浑浊.充分加热后,试管中留下白色固体.