题目内容
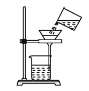
【题目】如图,在已调平的托盘天平两边各放一个等质量的烧杯,向烧杯中各加入一定量的等质量、等浓度的稀硫酸,然后在左盘的烧杯 A 中放入一定质量的 Zn 片,同时在右盘的烧杯 B 中放入与 Zn 片等质量的Fe 片。

(1)反应后烧杯 B 中的溶液变_____________色。
(2)若锌和 93.7g 稀硫酸恰好完全反应生成 0.2g 氢气,则反应后:
①所得溶液的溶质质量是___________?(请写出运算过程)
②所得溶液的溶质质量分数为______________(精确到 0.1%)
(3)若加入的稀硫酸是过量的,则在整个实验过程中指针的变化情况:________________。
【答案】浅绿 16.1g 16.1% 天平指针先偏右,最终指在分度盘左边
【解析】
(1)由于铁与稀硫酸反应生成了硫酸亚铁和氢气,反应后烧杯B中的溶液变浅绿色。
(2)①设反应锌的质量为x ,生成硫酸锌的质量为y

![]()
x=6.5g,y=16.1g
答:所得溶液的溶质质量是16.1g。
②所得溶液的溶质质量分数为:![]()
(3)![]()
![]()
锌的活动性比铁强,开始生成氢气快,天平指针先指向分度盘右边,根据比例关系可知,相同质量的锌、铁与过量的稀硫酸反应时,铁生成的氢气质量多,天平指针最终指在分度盘左边。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目