题目内容
(2011?朝阳区二模)某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液.为防止直接排放造成环境污染,对其进行了处理,过滤该残液,取100g 滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得实验数据如下表:
| 加入氢氧化钠溶液的总质量/g | 20 | 40 | 60 | 80 | 140 | 160 |
| 生成沉淀的质量/g | 1.07 | 2.14 | 5.35 | 5.35 |
通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液中溶质的质量分数.
【答案】分析:从表中的反应原理找出等量关系,利用所给的数据解出需要的数值.
解答:解:从表中加入的氢氧化钠可以看出40g以前没有生成沉淀,是在中和盐酸,140g和160g氢氧化钠都是生成沉淀5.35g,由于无法判断是否是60ge才开始沉淀,和140才完全沉淀,所以不能利用以上数值.但是从60到80,可以判定20g氢氧化钠一定对应2.14g-1.07g沉淀氢氧化铁沉淀.所以以此为计算依据.
设与生成2.14g-1.07g氢氧化铁所消耗的20g溶液中NaOH溶质的质量为x.
FeCl3+3NaOH═Fe(OH)3↓+3NaCl
120 107
x 2.14g-1.07g=1.07g
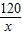 =
=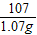
x=1.2g
NaOH%=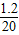 ×100%=6%
×100%=6%
答:氢氧化钠溶液中溶质的质量分数为6%.
点评:在解此类题时,首先分析题中的反应原理,然后根据表中所给的数据找出等量关系解出需要的答案,再求出质量分数.
解答:解:从表中加入的氢氧化钠可以看出40g以前没有生成沉淀,是在中和盐酸,140g和160g氢氧化钠都是生成沉淀5.35g,由于无法判断是否是60ge才开始沉淀,和140才完全沉淀,所以不能利用以上数值.但是从60到80,可以判定20g氢氧化钠一定对应2.14g-1.07g沉淀氢氧化铁沉淀.所以以此为计算依据.
设与生成2.14g-1.07g氢氧化铁所消耗的20g溶液中NaOH溶质的质量为x.
FeCl3+3NaOH═Fe(OH)3↓+3NaCl
120 107
x 2.14g-1.07g=1.07g
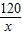 =
=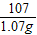
x=1.2g
NaOH%=
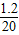 ×100%=6%
×100%=6%答:氢氧化钠溶液中溶质的质量分数为6%.
点评:在解此类题时,首先分析题中的反应原理,然后根据表中所给的数据找出等量关系解出需要的答案,再求出质量分数.

练习册系列答案
相关题目