题目内容
【题目】现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe═3FeCl2CuCl2+Fe═FeCl2+Cu.加入铁粉质量与反应就溶液中剩余固体质量的关系如图所示.
(1)m(剩余固体)>6.4g时,剩余固体的成分是(填化学式),此剩余固体加入盐酸,发生反应的化学方程式为 .
(2)原FeCl3和CuCl2的混合溶液中FeCl3的质量为g.
(3)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数(写出计算过程)
【答案】
(1)Cu和Fe;Fe+2HCl═FeCl2+H2↑
(2)32.5
(3)
设铁与氯化铜反应生成氯化亚铁的质量为z,生成铜的质量为m
CuCl2+Fe═FeCl2+Cu
56 127 64
5.6g z m
![]() ,
, ![]()
z=12.7g,m=6.4g,
反应后所得溶液中FeCl2的质量分数: ![]() =25.4%.
=25.4%.
答:反应后所得溶液中FeCl2的质量分数为25.4%.
【解析】解:(1)m(剩余固体)>6.4g时,2FeCl3+Fe═3FeCl2进行完,反应 CuCl2+Fe═FeCl2+Cu正在进行,剩余固体的成分是Cu和Fe;此剩余固体加入盐酸,发生反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

【题目】某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).查阅资料可知Mg、Mg3N2能发生如下反应:①2Mg+O2![]() 2MgO; ②3Mg+N2
2MgO; ②3Mg+N2![]() Mg3N2; ③2Mg+CO2
Mg3N2; ③2Mg+CO2![]() 2MgO+C;④Mg+H2O
2MgO+C;④Mg+H2O ![]() MgO+H2↑; ⑤Mg3N2+6H2O
MgO+H2↑; ⑤Mg3N2+6H2O ![]() 3Mg(OH)2↓+2NH3↑.
3Mg(OH)2↓+2NH3↑.
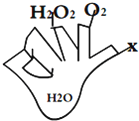
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).回答下列问题: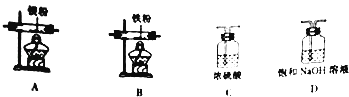
(1)连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是→→B→(填装置序号).D装置中发生反应的化学方程式为 .
(2)通气后,应向点燃(填“A”或“B”)装置的酒精灯,如果同时点燃A、B装置的酒精灯,对实验结果有何影响? .
(3)设计一个实验,验证产物是氮化镁:
实验操作和实验现象 | 实验结论 |
产物是氮化镁 |
(4)思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气正燃烧生成的MgO的质量却远大于Mg3N2的质量,请给出合理的解释 .