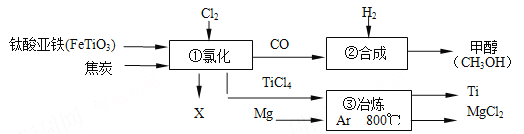
题目内容
【题目】(10分)某学校兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究。
【查阅资料】两者的热稳定性:
(1)食用纯碱受热不分解。
(2)食用小苏打270 ℃时完全分解为碳酸钠、二氧化碳、水
【实验探究】
(1)验证两种粉末的稳定性
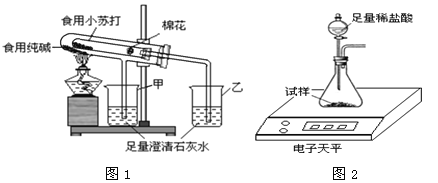
在老师的指导下,该小组按图1所示装置进行实验操作,观察到 (填“甲”或“乙”)烧杯中澄清石灰水变浑浊,小试管中发生反应的化学方程式为 __________ ,装置中棉花的作用是 。写出食用小苏打的一点用途_______________________。
(2)测定食用纯碱粉末的纯度
取食用纯碱粉末试样(假设只含少量氯化钠)22g放入烧杯中,向烧杯中加入200g足量的稀盐酸,充分反应后气体全部逸出,烧杯中剩余物的总质量为213.2g。
①反应生成CO2的质量为 g。
②通过计算确定食用纯碱粉末中Na2CO3的质量分数 (结果保留一位小数,下同)。
③如果测得的结果比实际纯度高,可能的原因是 (答一种即可)。
④求反应后所得溶液中溶质的质量分数(请写出计算过程)。
【答案】(1)乙 2NaHCO3△ Na2CO3+CO2↑+H2O
防止加热时小苏打粉末进入导管 治疗胃酸过多症(或焙制糕点的发酵粉)
(2)①8.8 ②96.4% ③稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大。(或水蒸气随CO2气体排出,从而导致所测纯度偏大)
④ 11.4%
【解析】
试题分析:(1)因为食用纯碱受热不分解,食用小苏打270 ℃时完全分解为碳酸钠、二氧化碳、水,按图1所示装置进行实验操作,观察到乙杯中澄清石灰水变浑浊,小试管中发生反应的化学方程式为:2NaHCO3△Na2CO3+CO2↑+H2O; 装置中棉花的作用是:防止加热时小苏打粉末进入导管;食用小苏打的一点用途:治疗胃酸过多症(或焙制糕点的发酵粉)
(2)①根据质量守恒定律,化学反应前后,物质的总质量不变,故反应生成CO2的质量=22g+200g-213.2g =8.8g
②根据化学反应方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中Na2CO3与CO2的质量关系,可计算出Na2CO3的质量,进而可计算食用纯碱粉末中Na2CO3的质量分数96.4%
③如果测得的结果比实际纯度高,可能的原因是:稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大。(或水蒸气随CO2气体排出,从而导致所测纯度偏大)
④根据化学反应方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中NaCl与CO2的质量关系,可计算出生成NaCl的质量,但由于反应前碳酸钠样品中还含有氯化钠,故应把这两部分的氯化钠质量都加起来
解:设样品中Na2CO3的质量为x,生成NaCl的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 8.8g
106 :44=x :8.8g
x=21.2g
117:44=y :8.8g
y=23.4g
氯化钠的质量=23.4g+(22g-21.2g)=24.2g
反应后所得溶液中溶质的质量分数=24.2g/213.2g×100%=11.4%
答:所得溶液中溶质的质量分数为11.4%