题目内容
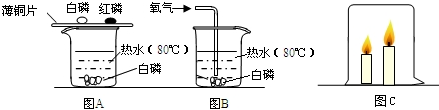
某学校化学兴趣小组同学在学习了制取氧气这一节内容后,发现在实验室里用5%过氧化氢(H2O2)溶液加热制氧气,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是
第一组:同学们采取增大H2O2溶液浓度的方法,用10%的H2O2溶液加热,结果一段时间后,用带火星的木条检验,木条复燃;
第二组:同学们在5%的H2O2溶液中加入2滴新制氢氧化钠溶液,加热一段时间后,用带火星木条检验,木条复燃;
第三组:同学们从实验装置上进行了改进(见右图),效果很好.在实验基础上,同学们经过交流讨论,得出了一些结论:
(1)由第一组同学的实验可得出:影响H2O2分解产生氧气的量的多少及分解快慢的因素
 之一是
之一是(2)由第二组同学的实验可分析得出,氢氧化钠所起的作用可能是
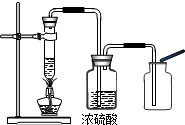
(3)第三组同学的实验验证了实验前同学们猜想的正确性,查阅资料知,浓硫酸在实验中常用作干燥剂,你分析第三组的同学对实验装置进行改进后,效果较好的原因可能是
(4)小明同学认真观察了第三组同学的实验装置,结合化学实验基本操作知识和氧气的物理性质,提出了一种更简单的改进装置,经现场实验,效果很好,请你写出他的改进方法(或画出他的实验装置改进简图)
对比实验改进后实验中发生了改变的因素,分析该因素的改变对产生氧气量或速度的影响,归纳出所做的改变造成氧气量增加的原因;
根据实验基础操作,对试管内液体进行加热时,为使液体受热均匀,试管与桌面应成45°角,这样可使试管内反应平稳.
(1)实验改用10%的H2O2溶液加热,观察到木条复燃,说明影响H2O2分解产生氧气的量的多少及分解快慢的因素为H2O2溶液浓度的大小;
(2)实验改用向5%的H2O2溶液中加入2滴新制氢氧化钠溶液,观察到木条复燃,可推断氢氧化钠起到类似二氧化锰的催化作用或是起到减少水分蒸发的目的;
(3)实验把产生的气体通过具有吸水性的浓硫酸,得到干燥的气体,观察到木条复燃,可说明浓硫酸吸收了气体中的水蒸气,使氧气的浓度增大;
(4)第三组实验中,对溶液进行加热时,没有使试管与桌面成45°角,会出现液体受热不均匀而冲出.
故答案为:
大量水蒸气对实验造成了干扰.
(1)H2O2溶液浓度的大小;
(2)促进H2O2分解,减少水分蒸发;
(3)浓硫酸吸收了气体中的水蒸气,使氧气的浓度增大.
(4)加热时试管倾斜于桌面大约成45°角.(或画图说明)

 阅读快车系列答案
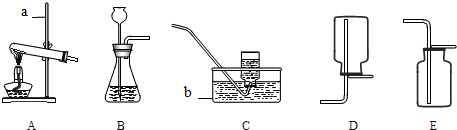
阅读快车系列答案实验室常用下列装置来制取氧气:
![]()




A B C D E
(1)写出图中有标号仪器的名称:a ;b 。
(2)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是 (填序号)。
(3)用高锰酸钾制取氧气时,反应的文字表达式式为 。
(4)用E装置收集氧气的依据是 。
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。若制取并收集氨气,应该从上图中选择的发生装置和收集装置分别是 。
(6)某学生学习了双氧水制氧气的实验后,想起自己家里也有一瓶
 消毒用双氧水,由于标签已部分受损无法判断其是否变质,所以
消毒用双氧水,由于标签已部分受损无法判断其是否变质,所以
他将该瓶溶液带到学校,进行了如图所示的研究。试回答:
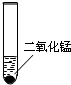
①放入二氧化锰的作用是 。
②如果该溶液未变质,应该观察到的现象是 ,
③将未过期的这种双氧水滴在伤口上,迅速出现大量气泡,你认为该气体是 。
【继续回答下列问题,你可以获得奖励分数,最多奖励4分,但化学总分不得超过60分】
(7)用过氧化氢和二氧化锰为原料,使用B装置制取氧气时,收集完氧气后,反应还在继续进行。小明同学认为,这个装置的缺点是不能控制反应随时发生、随时停止,造成了药品的浪费。为了解决小明提出的问题,请你对原实验装置加以改进,或设计新的简易实验装置,以便有效地控制过氧化氢的分解反应。(请你至少写出两种设计方案)
(友情提示:你可从下列用品中选取,也可自行选用其他仪器)。

分液漏斗 装有二氧化锰的小布袋 注射器 大试管 止水夹
序号 | 你设计的实验操作方案 |
方案一 | |
方案二 |