题目内容
【题目】某同学设计了如下图所示的装置,用于制取CO2,并对它的部分性质进行探究,按要求回答问题。

①写出仪器I的名称:_________。
②B装置用于制取CO2,反应的化学方程式为__________。欲停止反应,应采取的操作是_______,待反应完全停止后,容器中的液面位置为__________(填“a”、“b”或“c”)。
③用如图装置收集CO2,请将装置内的导管补充完整__________。

④若要C中的两个气球悬浮在空气中,气体甲可能是________(填序号)。
I. 氢气 II. 氧气 III. 空气 IV. 二氧化碳
⑤往D试管中通入CO2,当出现________现象,表示石灰水中的溶质恰好完全转化为沉淀。
⑥加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其化学方程式分别是:
I. ![]()
II. ![]()
某同学采用反应I的方法制取CO2,发生装置应该选用上图中的________(填编号),他不选择反应II制取CO2的理由是______。
【答案】长颈漏斗 CaCO3+2HCl→CaCl2+H2O+CO2↑ 夹紧弹簧夹 c 左边导气管延长至试管底部,图略 I 溶液由红色变为无色 A 气体产物除CO2外还有NH3,导致收集的CO2不纯
【解析】
①仪器I的名称:长颈漏斗;
②碳酸钙与稀盐酸反应生成CO2,反应的化学方程式为:CaCO3+2HCl→CaCl2+H2O+CO2↑;欲停止反应,应采取的操作是夹紧弹簧夹,待反应完全停止后,稀盐酸与大理石分离,故容器中的液面位置为c;
③
④若要图C中的两个气球悬浮在空气中,则气体甲可能是氢气,因为氢气的密度比空气小,故选Ⅰ;
⑤由于石灰水显碱性,能使酚酞溶液变红。若石灰水中的溶质恰好完全转化为沉淀,则溶液显中性,不能使酚酞溶液变红。故往D试管中通入CO2,当出现溶液由红色变为无色时,表示石灰水中的溶质恰好完全转化为沉淀;
⑥加热碳酸氢钠的方法制取CO2,反应需要加热,需使用A装置。不选用碳酸氢铵制取CO2的理由是:气体产物除CO2外还有NH3,导致收集的CO2不纯。

【题目】某同学为了测定实验室中氯酸钾样品的纯度。取2.5克该样品与0.5克二氧化锰混合,加热一段时间后(杂质不参加反应),冷却,称量剩余物质量,重复上述操作,记录数据如下表:
加热时间 | T1 | T2 | T3 | T4 |
剩余物质量 | 2.12 | 2.08 | 2.04 | 2.04 |
①加热到T2时间后,氯酸钾是否已经反应完全?_____
②样品中氯酸钾的质量分数_______
【题目】如表是 NaCl、NH4Cl 在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | |
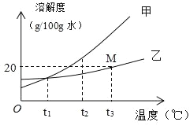
(1)以上两种物质的溶解度受温度影响较大的是_____。
(2)40℃时,将 40.6g NaCl 加入到 100g 水中,充分搅拌使之溶解,所得溶液的质量为_____g。
(3)20℃时,NaCl 饱和溶液的溶质质量分数为(精确到小数点后 1 位)_____。