题目内容
【题目】豆腐是人们喜爱的食物,营养丰富,能为人体提供所需的多种氨基酸,其中含量最多的是亮氨酸(C6H13NO2 ),关于亮氨酸的说法正确的是( )
A. 亮氨酸是氧化物
B. 亮氨酸中碳、氢、氮、氧四种元素的质量比为72:13:14:32
C. 一个亮氨酸分子由21个原子构成
D. 亮氨酸中碳元素的质量分数为27.5%
【答案】B
【解析】A、氧化物是指由两种元素组成,其中一种元素是氧元素的化合物,亮氨酸(C6H13NO2 )是由四种元素组成,错误;
B、亮氨酸中碳、氢、氮、氧四种元素的质量比为![]() =72:13:14:32,正确;
=72:13:14:32,正确;
C、1个一个亮氨酸分子中含有6个碳原子,13个氢原子,1个氮原子和2个氧原子,共有22个原子,错误;
D、亮氨酸中碳元素的质量分数=![]() =55.0%,错误。故选B。
=55.0%,错误。故选B。

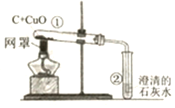
【题目】同学们在学习金属的化学性质时,做了稀盐酸、稀硫酸分别与锌、铜反应的实验,实验结束后,对酸的性质很感兴趣,于是又继续研究稀硝酸(![]() )的性质,在老师的带领下进行了以下实验探究。
)的性质,在老师的带领下进行了以下实验探究。
(实验探究)
实验内容 | 实验现象 | 结论与分析 |
(1)用玻璃棒蘸取稀硝酸滴到pH试纸上,与________比较,读出pH。 | pH试纸变红色 | pH=1,稀硝酸显________性 |
(2)取少量氢氧化钠溶液于试管中,滴入几滴酚碱溶液,再逐滴加入稀硝酸,振荡。 | 溶液的颜色变化情况是_______ | 稀硝酸与氢氧化钠发生了中和反应。反应的化学方程式_______ |
(3)再分别在盛有少量锌粉、铜粉的试管中加入2mL的稀硝酸,观察实验现象。 | 在两支试管的溶液中均冒出气泡,产生无色气体A,在试管口气体A变成红棕色有刺激性气味的气体B | 锌、铜都能与稀硝酸反应,产生气体A |
(提出疑问):无色气体A是什么?
(查阅资料)含氮元素的某些气态物质的物理性质:
|
|
|
| |
颜色 | 无色 | 无色 | 无色 | 红棕色 |
溶解性 | 极易溶于水 | 难溶于水 | 可溶于水或硝酸 |
(交流与拓展)通过分析资料,大家一致认同了红棕色气体B是![]() ,但对无色气体A及其变化的原因有不同的看法。
,但对无色气体A及其变化的原因有不同的看法。
①小南同学认为A不可能是![]() ,他的理由是________。
,他的理由是________。
②小宁同学认为A是![]() ,却遭到大家的一致反对,原因是________。
,却遭到大家的一致反对,原因是________。
(实验结论)经讨论,最终一致认为A是![]() ,
,![]() 在试管口遇氧气生成了
在试管口遇氧气生成了![]() 。
。
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
解释 | 集气瓶中的水: 吸收放出的热量 | 集气瓶中的水: 更快地吸收白烟 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落融熔物,防止集气瓶炸裂 |
A | B | C | D |
A. AB. BC. CD. D
【题目】人教版新课标化学教材九年级上册(2012教育部审定)“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
|
(实验结论)
(1)A中产生的气体是______________;
(2)实验II、III证明:氧化铁的__________和__________在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的符号表达式______________________。
(实验评价)
(1)实验设计IV的目的是____________________;
(2)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是_______________。