题目内容
【题目】用化学语言表示:
(1)1个氯分子_____,2个铁原子_____,正二价的钙元素_____,硝酸银_____
(2)地壳中含量最多的金属,人体中含最多的元素,组成密度最小气体的元素,这三种元素组成的物质的化学式是_____,其中的原子团名称是_____
【答案】Cl2 2Fe ![]() AgNO3 Al(OH)3 氢氧根
AgNO3 Al(OH)3 氢氧根
【解析】
(1)分子的表示方法,正确书写物质的化学式,表示多个该分子,在其化学式前加上相应的数字。1个氯分子可以表示为Cl2;
原子的表示方法是用元素符号来表示一个原子,表示多个该原子,在其元素符号前加上相应的数字。2个铁原子可以表示为2Fe;
元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后。正二价的钙元素可以表示为![]() ;
;
硝酸银化学式表示为AgNO3。
(2)地壳中含量最多的金属是铝元素,人体中含最多的元素是氧元素,组成密度最小气体的元素是氢元素,这三种元素组成的物质是氢氧化铝,可以表示为Al(OH)3,其中的原子团名称是氢氧根。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】向一定量的NaOH溶液中慢慢通入CO2气体,看不到明显现象。某实验小组的同学对所得溶液成分进行了如下探究。请你参与他们的探究活动,并完成以下问题:
(提出问题)所得溶液中溶质的成分是什么?
(査阅资料)资料一:将CO2气体慢慢地通入一定量的NaOH溶液中,可能发生以下两个化学反应:
先发生反应:2NaOH+CO2═Na2CO3+H2O
当NaOH反应完全后,继续发生反应:Na2CO3+CO2+H2O═2NaHCO3
資料二;Ca(HCO3)2易溶于水;CaCl2溶液与NaCl溶液均呈中性; NaHCO3溶液呈碱性,可使酚酞溶液变红色。
(猜想与假设)小组同学通过讨论,提出了以下四种猜想
猜想一:溶质为NaOH和Na2CO3
猜想二:溶质全为Na2CO3
(1)你认为猜想三:溶质为_____
猜想四:溶质全为 NaHCO3
(实验探究)小组同学设计并完成了如下实验:
实验步骤 | 实验过程 | 实验现象 | 实验结论 |
① | 取适量反应后的溶液置于试管 中,加入过量CaCl2溶液 | 有白色沉淀生成 | (2)猜想_____不成立 |
② | 取适量步骤①反应后的上层清 液,滴加几滴酚酞溶液 | (3)现象为_____ | 猜想二不成立 |
③ | 取适量步骤①反应后的上层清 液,加入适量稀HCl | 有气泡产生 | (4)猜想_____成立 |
(实验总结)针对上述实验,实验小组的同学总结并写出了上述探究过程中的各步反应方程式。
(5)你认为步骤①发生反应的化学方程式是_____。
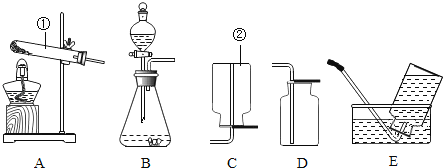
【题目】某同学对“影响稀盐酸和大理石反应快慢的因素”进行探究.选取的药品:成分相同的粉末状大理石、块状大理石两种样品;浓度为16%、9%的稀盐酸.采用控制变量法设计实验方案,以5分钟内收集到CO2的质量作为判断依据.已知稀盐酸足量且样品中杂质不与稀盐酸反应,实验装置如图.读取电子天平的示数,据此计算生成的CO2的质量,记录的数据如表
实验序号 | 大理石 (各6g) | 稀盐酸的浓度 | 反应开始到5分钟产生CO2的质量 | 反应结束产生的CO2的质量 |
① | 块状 | 16% | 2.16g | 2.2g |
② | 块状 | 9% | 1.42g | 2.2g |
③ | 粉末 | 16% | 2.33g | 2.2g |
④ | 粉末 | 9% | 1.93g | m2 |
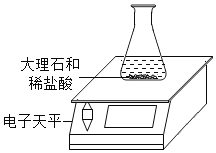
(1)稀盐酸的浓度对该反应快慢的影响:_____.
(2)实验过程中,通过观察如图装置中的哪一现象可判断反应结束_____.
(3)结合表格分析,实验④反应结束后m2的值_____.
(4)探究大理石的颗粒大小对该反应快慢的影响,其实验序号分别是_____.
(5)计算该大理石(6g)样品中含碳酸钙的质量为_____.