题目内容
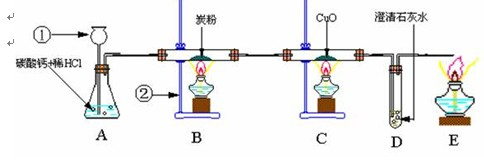
(9分)实验室常用石灰石与稀盐酸制取C02,某同学设计了两种制取CO2的部分装置(见右图).

(1)实验室制取C02的化学方程式为: ·
(2)仪器A的名称是:▲ ,
(3)图1装置的不规范之处是:▲ ;
(4)用图2装置C02时,要使反应停止,最简便的操作方法是:▲ ;
(5)实验时,向盛有石灰石的试管中加入足量稀盐酸后,发现石灰石表面仅有极少量气泡产生,原因可能是 ;
(6)若实验室需制备2.2 L C02;.理论上需纯度为80﹪的石灰石多少克,(假设该状态下C02的密度为2克/L)。

(1)实验室制取C02的化学方程式为: ·
(2)仪器A的名称是:▲ ,
(3)图1装置的不规范之处是:▲ ;
(4)用图2装置C02时,要使反应停止,最简便的操作方法是:▲ ;
(5)实验时,向盛有石灰石的试管中加入足量稀盐酸后,发现石灰石表面仅有极少量气泡产生,原因可能是 ;
(6)若实验室需制备2.2 L C02;.理论上需纯度为80﹪的石灰石多少克,(假设该状态下C02的密度为2克/L)。
(1)CaC03+2HCl===CaCI2+CO2+H20 (2分)
(2)长颈漏斗(1分)
(3)铁夹夹在试管的底都(1分)
(4)关闭活塞(1分)
(5)石灰石中碳酸钙的含量过低或稀盐酸的浓度过低(1分)
(6)解:设碳酸钙的质量为x
m(CO2)=2克/L X 2.2L =4.4克 (1分)

(2)长颈漏斗(1分)
(3)铁夹夹在试管的底都(1分)
(4)关闭活塞(1分)
(5)石灰石中碳酸钙的含量过低或稀盐酸的浓度过低(1分)
(6)解:设碳酸钙的质量为x
m(CO2)=2克/L X 2.2L =4.4克 (1分)

分析:(1)根据反应物和反应原理书写化学方程式;
(2)根据仪器的图象和用途判断仪器名称;
(3)根据装置特点找出不规范之处;
(4)通过分离反应物来停止反应;
(5)从反应物的角度分析产生二氧化碳少的原因;
(6)可首先二氧化碳的体积换算成质量,利用化学方程式,列出比例式进行求解碳酸钙的质量,然后利用质量分数求出石灰石的质量.
解答:解:(1)实验室制取C02用石灰石和稀盐酸反应,化学方程式为:CaC03+2HCl═CaCl2+CO2↑+H20,注意配平和气体符号;
(2)仪器A的名称是:长颈漏斗;
(3)从图1装置的看,铁夹夹在试管的底部,应该夹在试管的中上部;
(4)用图2装置C02时,要使反应停止,最简便的操作方法是关闭活塞,试管中的气体排不出来,压强增大,把盐酸压回长颈漏斗,使固液分离,反应停止;
(5)实验时,向盛有石灰石的试管中加入足量稀盐酸后,发现石灰石表面仅有极少量气泡产生,原因可能是石灰石中碳酸钙的含量过低或稀盐酸的浓度过低;
(6)根据二氧化碳的质量通过化学方程式进行计算.
故答案为:(1)CaC03+2HCl═CaCl2+CO2↑+H20
(2)长颈漏斗
(3)铁夹夹在试管的底部
(4)关闭活塞
(5)石灰石中碳酸钙的含量过低或稀盐酸的浓度过低
(6)解:设碳酸钙的质量为x
m(CO2)=2克/L×2.2L=4.4克
CaC03+2HCl═CaCl2+CO2↑+H20
100 44
x 4.4g
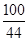 =
=
x=10g
石灰石的质量为10g÷80%=12.5g
答:理论上需纯度为80%的石灰石12.5g.
点评:此题综合考查了实验室制取二氧化碳的装置特点和根据化学方程式进行的计算,要根据已有知识进行灵活运用,只有这样才能完整准确的完成题目.
(2)根据仪器的图象和用途判断仪器名称;
(3)根据装置特点找出不规范之处;
(4)通过分离反应物来停止反应;
(5)从反应物的角度分析产生二氧化碳少的原因;
(6)可首先二氧化碳的体积换算成质量,利用化学方程式,列出比例式进行求解碳酸钙的质量,然后利用质量分数求出石灰石的质量.
解答:解:(1)实验室制取C02用石灰石和稀盐酸反应,化学方程式为:CaC03+2HCl═CaCl2+CO2↑+H20,注意配平和气体符号;
(2)仪器A的名称是:长颈漏斗;
(3)从图1装置的看,铁夹夹在试管的底部,应该夹在试管的中上部;
(4)用图2装置C02时,要使反应停止,最简便的操作方法是关闭活塞,试管中的气体排不出来,压强增大,把盐酸压回长颈漏斗,使固液分离,反应停止;
(5)实验时,向盛有石灰石的试管中加入足量稀盐酸后,发现石灰石表面仅有极少量气泡产生,原因可能是石灰石中碳酸钙的含量过低或稀盐酸的浓度过低;
(6)根据二氧化碳的质量通过化学方程式进行计算.
故答案为:(1)CaC03+2HCl═CaCl2+CO2↑+H20
(2)长颈漏斗
(3)铁夹夹在试管的底部
(4)关闭活塞
(5)石灰石中碳酸钙的含量过低或稀盐酸的浓度过低
(6)解:设碳酸钙的质量为x
m(CO2)=2克/L×2.2L=4.4克
CaC03+2HCl═CaCl2+CO2↑+H20
100 44
x 4.4g
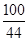 =
=
x=10g
石灰石的质量为10g÷80%=12.5g
答:理论上需纯度为80%的石灰石12.5g.
点评:此题综合考查了实验室制取二氧化碳的装置特点和根据化学方程式进行的计算,要根据已有知识进行灵活运用,只有这样才能完整准确的完成题目.

练习册系列答案
相关题目
 ”这一角度分析干冰具有的性质和用途
”这一角度分析干冰具有的性质和用途 C6H12O6+6O2
C6H12O6+6O2 2CO
2CO