题目内容
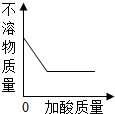 有一包白色粉末,可能由NaOH、K2SO4、Ba(NO)2、MgCl2、KNO3中的一种或多种组成.取少量该白色粉末于烧杯中,向烧杯中加入足量水搅拌后,观察到有白色不溶物存在,向不溶物中加入足量酸,根据加酸过程中观察到的现象绘制如图所示图象.结合图象判断下列说法合理的是( )
有一包白色粉末,可能由NaOH、K2SO4、Ba(NO)2、MgCl2、KNO3中的一种或多种组成.取少量该白色粉末于烧杯中,向烧杯中加入足量水搅拌后,观察到有白色不溶物存在,向不溶物中加入足量酸,根据加酸过程中观察到的现象绘制如图所示图象.结合图象判断下列说法合理的是( )分析:根据题干提供的信息进行分析,氯化镁能与氢氧化钠反应生成氢氧化镁沉淀,该沉淀可以溶于酸,氯化钡能与硫酸钾反应生成硫酸钡沉淀,该沉淀不溶于酸,据此分析解答;
解答:解:A、沉淀最终没有全部溶解,所以该沉淀中一定含有不溶于酸的硫酸钡和溶于酸的氢氧化镁,故原固体中至少含有四种物质,分别是氯化镁、氢氧化钠和氯化钡、硫酸钾;
B、依据A的分析可知白色不溶物一定为Mg(OH)2和BaSO4;
C、由于固体中含有氯化镁,所以加水后得到的液体中一定含有Cl-;
D、稀硫酸也能与氢氧化镁沉淀反应,而沉淀没有完全溶解,所以酸可以是稀硫酸;
故选A
B、依据A的分析可知白色不溶物一定为Mg(OH)2和BaSO4;
C、由于固体中含有氯化镁,所以加水后得到的液体中一定含有Cl-;
D、稀硫酸也能与氢氧化镁沉淀反应,而沉淀没有完全溶解,所以酸可以是稀硫酸;
故选A
点评:本题考查了常见混合物的组成的推断,完成此题,可以依据题干提供的信息结合已有的物质间反应的知识进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
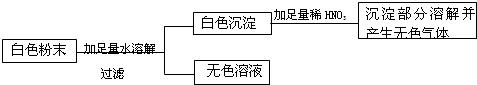
(1)有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,经实验得到下表,请完成相关内容.
(2)某化学兴趣小组为测定该包白色粉末中碳酸钠的质量分数,取该样品44.6g,加286.2克水溶解制成溶液后投入146克稀盐酸中完全反应,共收集到二氧化碳气体8.8g.求:(1)该碳酸钠样品中碳酸钠的质量分数;(2)反应所得溶液中溶质的质量分数.
| 实验步骤及现象 | 结论 |
| ①将少许白色粉末溶于水得到无色溶液A | 白色粉末中一定没有 |
| ②在A中加入足量硝酸钡溶液,生成白色沉淀B,过滤得滤液C ③在白色沉淀B中加入足量稀硝酸, ④在滤液C中加入硝酸银溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解. |
白色粉末中一定有 碳酸钠和氯化钠 |
 (2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )
(2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )