题目内容
【题目】活性氧化锌在橡胶工业、陶瓷工业、国防工业中有着重要的应用。某科研小组设计利用稀硫酸浸取某废弃的氧化铜锌矿(主要成分为ZnO和CuO,其余成分不与酸反应,也不溶于水)的方案,制备活性氧化锌。部分实验流程如下:
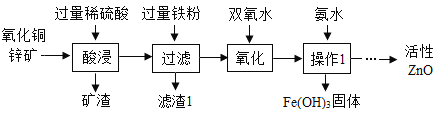
请根据上述实验流程回答下列问题:
(1)操作Ⅰ的名称是_____。
(2)酸浸中发生反应的的化学方程式是_____(任写一个),该反应的基本反应类型是_____。
(3)滤渣1的成分为_____(填化学式)。
(4)氧化过程是双氧水将Fe2+反应生成Fe3+和水,便于将溶液中的铁元素除去。高锰酸钾也能将Fe2+氧化成Fe3+。选择双氧水的优点是_____。
【答案】过滤 ![]() 复分解反应 Fe、Cu 反应后不生成新的杂质
复分解反应 Fe、Cu 反应后不生成新的杂质
【解析】
(1)经过操作Ⅰ之后,实现固液分离,所以操作为过滤;
故答案为:过滤。
(2)氧化铜锌矿含有氧化铜和氧化锌,两种都可以与硫酸反应,氧化锌与硫酸反应生成硫酸锌和水,氧化铜与硫酸反应生成硫酸铜和水,另外在加入铁粉后,铁与硫酸反应生成硫酸亚铁和氢气,铁还可以与硫酸铜反应生成铜和硫酸亚铁,因此从其中任选一个书写即可,此处选择氧化锌与硫酸反应书写,其他合理答案亦可,故化学方程式为![]() ;该反应是两种化合物反应,相互交换组分,并且有水的生成,所以符合复分解反应的特点;
;该反应是两种化合物反应,相互交换组分,并且有水的生成,所以符合复分解反应的特点;
故答案为:![]() ;复分解反应。
;复分解反应。
(3)在氧化铜锌矿中加入过量稀硫酸后,生成的溶液中含有硫酸铜和硫酸锌,以及剩余的稀硫酸,加入铁粉,由于铁的金属活动性强于铜和氢,所以会发生置换反应,铁与硫酸反应生成硫酸亚铁和氢气,铁与硫酸铜反应生成铜和硫酸亚铁,铁的金属活动性弱于锌,所以不能置换出锌,因此固体为生成的铜和剩余的铁,由这两种固体组成滤渣1;
故答案为:Fe、Cu。
(4)双氧水为过氧化氢的水溶液,其发生反应后,生成了水,不引入其他杂质;
故答案为:反应后不生成新的杂质。

 孟建平名校考卷系列答案
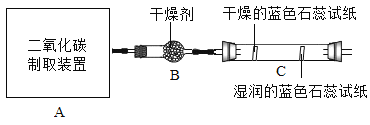
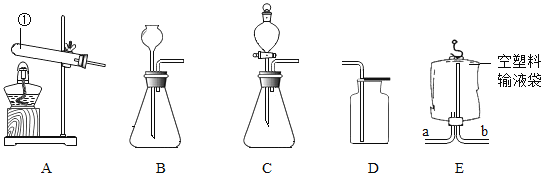
孟建平名校考卷系列答案【题目】制造物质、研究物质 小博同学想组装一套能控制反应速率,获得平稳气流的实验室制取二氧化碳装置,则发生装置应选择_________ (填序号)装置,利用装置 E 收集二氧化碳,气体应从_________(填“a”或“b”)端通入;
小博同学运用所制得的二氧化碳采用用对比实验方法探究二氧化碳的性质,请根据下列实验要求回答相关问题:
实验一 | 实验二 |
|
|
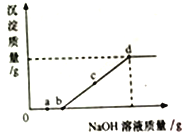
实验一:振荡 3 个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为 A>B>C, 其中 B 瓶石灰水变浑浊,此反应的化学方程式为_________; 对比_________瓶(选填“A”“B”或“C”)的塑 料瓶变瘪的程度,可证明 CO2 能与 NaOH 发生反应。
实验二:观察到 C 装置中发生的现象是:_________蓝色石蕊试纸_________;此实验可证明__________发生反应。