题目内容
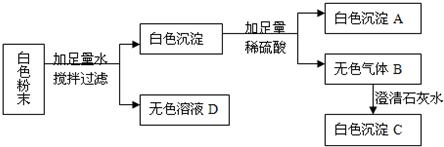
有一包白色粉末可能由CaCO3、Na2SO4、BaCl2、NaCl中的一种或几种组成。把少量该粉末放入足量水中,搅拌、静置、过滤,得到白色固体和滤液。向所得固体中加入稀硝酸,固体全部溶解并有气体放出。向所得溶液中加入稀硫酸,有白色固体生成。该粉末中肯定没有的物质是( )
A.CaCO3 B.Na2SO4 C.BaCl2 D.NaCl
【答案】
B
【解析】
试题分析:根据题意,该粉末放入足量水中,搅拌、静置、过滤,得到白色固体,则该白色固体可能是碳酸钙,也可能是硫酸钠与氯化钡反应产生的硫酸钡沉淀;向所得固体中加入稀硝酸,固体完全溶解并有气体放出,说明沉淀不是硫酸钡,只有碳酸钙,因此硫酸钠与氯化钡不能同时存在;再向所得滤液中加入稀硫酸,有白色沉淀生成,说明一定有氯化钡,因此一定没有硫酸钠。故选B
考点:物质的鉴别、推断
点评:理解和熟练掌握常见物质的性质,是解题的关键;并能根据物质的化学特性,结合题意寻找问题的突破口,如在本题中,“向所得固体中加入稀硝酸,固体全部溶解并有气体放出”,即说明沉淀为碳酸盐。

练习册系列答案
相关题目