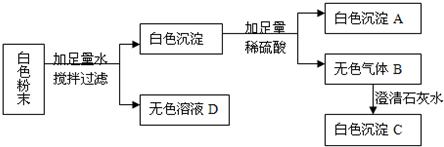
题目内容
有一包白色粉末可能由Na2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种组成.小刚为了测定该白色粉末的组成,设计了如下实验.
请根据上图实验现象帮助小刚判断:
(1)白色沉淀A是______,白色粉末中一定不含______,肯定含______.
(2)写出B→C的化学方程式______.
解:(1)依据白色粉末加水后会生成无色液体和白色沉淀,说明一定不存在硫酸铜,无色气体B和澄清石灰水会生成白色沉淀C,所以B就是二氧化碳,C就是碳酸钙,白色沉淀和硫酸反应会生成二氧化碳和沉淀,但是硫酸会引入硫酸根离子,所以白色沉淀中一定有碳酸钡,硫酸钡不能确定,所以混合物中一定存在碳酸钠和氯化钡,不能确定硫酸钠的存在,
故答案为:BaSO4;CuSO4;Na2CO3、BaCl2
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,故答案为:CO2+Ca(OH)2=CaCO3↓+H2O.
分析:(1)根据铜离子在溶液中显蓝色,碳酸钡沉淀会溶于酸,硫酸钡沉淀不会溶于酸进行分析;
(2)根据(1)中推出的反应物、生成物书写方程式.
点评:在解此类题时,首先分析混合物中各物质的性质,然后结合题中的现象进行分析混合物的成分.
故答案为:BaSO4;CuSO4;Na2CO3、BaCl2
(2)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,故答案为:CO2+Ca(OH)2=CaCO3↓+H2O.
分析:(1)根据铜离子在溶液中显蓝色,碳酸钡沉淀会溶于酸,硫酸钡沉淀不会溶于酸进行分析;
(2)根据(1)中推出的反应物、生成物书写方程式.
点评:在解此类题时,首先分析混合物中各物质的性质,然后结合题中的现象进行分析混合物的成分.

练习册系列答案
相关题目