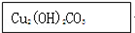题目内容
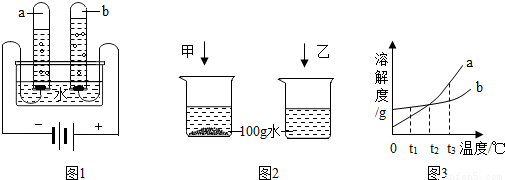
水和溶液在实验室和日常生产生活中有很多用途.(1)在图1所示的实验中,a、b两支试管中气体理论上的质量比 ,由该实验可得出水的组成元素是 .
(2)在天然水中有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的是 .
(3)溶液是日常生活中的常见物质,请根据图所示内容回答:
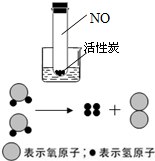
①在t1℃时,等质量的甲和乙两种固体物质在水中的溶解现象如图2所示,一定是饱和溶液的是 (填“甲”“乙”),在保持t1℃的情况下,要使剩余的固体继续溶解可采用的方法是 .
②若图3中a、b分别表示甲、乙两种物质的溶解度曲线,乙的曲线是 .
③下列叙述正确的是 .
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.将甲、乙的饱和溶液从t3℃降到t2℃,析出甲的质量大
C.将t3℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D.t2℃时,甲和乙的饱和溶液各100g,其溶质的质量分数相等.
【答案】分析:(1)根据电解水实验的现象和结论分析回答;
(2)根据净化水的效果分析;
(3)①根据饱和溶液、不饱和溶液的定义及转化的方法分析;
②根据在t1℃时溶解度的大小分析判断;
③根据溶解度曲线的意义分析.
解答:解:(1)由电解水的实验装置可知,a试管收集的是电源的负极产生的气体较多是氢气,b试管收集的是电源的负极产生的气体较少是氧气,两支试管中气体理论上的质量比1:8,由该实验可得出水的组成元素是氢和氧元素;
(2)在常见的净化水的措施吸附、沉淀、过滤和蒸馏等方法中,蒸馏能得到纯净的水.是净化程度最高的;
(3)①由图示可知,在甲烧杯中不能再溶解溶质了是饱和溶液,在保持t1℃的情况下,要使剩余的固体继续溶解可采用的方法是加足量的水;
②由在t1℃时等量的水中溶解溶质的情况可知,b的溶解度较大,所以,乙的曲线是b;
③A.要比较溶解度的大小,必须指明温度,故A错误;
B.析出晶体的多少与饱和溶液的质量有关,故B错误;
C.由于甲的溶解度随温度的升高而增大.所以,将t3℃时甲的饱和溶液变为不饱和溶液,可采取升温的方法.故C错误;
D.由甲乙的溶解度曲线可知,在t2℃时曲线交与一点,此时的溶解度相同,则甲和乙的饱和溶液各100g,其溶质的质量分数相等.故D正确.
故答为:(1)1:8,氢和氧元素;(2)蒸馏;(3)①甲; 加足量的水;②b;③D.
点评:本题考查了水的组成、饱和溶液与不饱和溶液、溶解度的定义、溶解度曲线的意义等知识,是一道综合性、实验性较强的题目.
(2)根据净化水的效果分析;
(3)①根据饱和溶液、不饱和溶液的定义及转化的方法分析;
②根据在t1℃时溶解度的大小分析判断;
③根据溶解度曲线的意义分析.
解答:解:(1)由电解水的实验装置可知,a试管收集的是电源的负极产生的气体较多是氢气,b试管收集的是电源的负极产生的气体较少是氧气,两支试管中气体理论上的质量比1:8,由该实验可得出水的组成元素是氢和氧元素;
(2)在常见的净化水的措施吸附、沉淀、过滤和蒸馏等方法中,蒸馏能得到纯净的水.是净化程度最高的;
(3)①由图示可知,在甲烧杯中不能再溶解溶质了是饱和溶液,在保持t1℃的情况下,要使剩余的固体继续溶解可采用的方法是加足量的水;
②由在t1℃时等量的水中溶解溶质的情况可知,b的溶解度较大,所以,乙的曲线是b;
③A.要比较溶解度的大小,必须指明温度,故A错误;
B.析出晶体的多少与饱和溶液的质量有关,故B错误;
C.由于甲的溶解度随温度的升高而增大.所以,将t3℃时甲的饱和溶液变为不饱和溶液,可采取升温的方法.故C错误;
D.由甲乙的溶解度曲线可知,在t2℃时曲线交与一点,此时的溶解度相同,则甲和乙的饱和溶液各100g,其溶质的质量分数相等.故D正确.
故答为:(1)1:8,氢和氧元素;(2)蒸馏;(3)①甲; 加足量的水;②b;③D.
点评:本题考查了水的组成、饱和溶液与不饱和溶液、溶解度的定义、溶解度曲线的意义等知识,是一道综合性、实验性较强的题目.

练习册系列答案
相关题目


 3月22日是“世界水日”,2011年“世界水日”的宣传主题为:“城市用水:应对都市化挑战”.水与人类的生活和生产密切相关.请回答以下相关问题:
3月22日是“世界水日”,2011年“世界水日”的宣传主题为:“城市用水:应对都市化挑战”.水与人类的生活和生产密切相关.请回答以下相关问题:
 A.某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水.当地的其他工厂和居民均用煤炭作燃料.只要下雨就下酸雨,对该镇环境造成极大破坏.
A.某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水.当地的其他工厂和居民均用煤炭作燃料.只要下雨就下酸雨,对该镇环境造成极大破坏.
 2CuO+CO2↑+H2O,Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O.
2CuO+CO2↑+H2O,Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O.