题目内容
【题目】铁是现代化学工业的基础,人类进步所必不可少的金属材料。
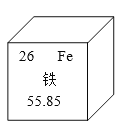
⑴看图回答,铁元素的原子序数为 ,相对原子质量为 。亚铁离子(Fe2+)的核外电子数为 ,质子数为 。
⑵健康人体内,总量4~5g的铁元素主要以化合物形式存在,缺铁会患上 (填字母)。
A.骨质疏松 B.甲状腺疾病 C.贫血症 D.侏儒症
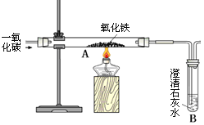
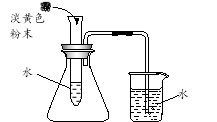
【实验一】兴趣小组通过上图实验研究铁的冶炼
⑶该装置的设计有一明显不当之处,你的改进方案是 。
⑷试写出一氧化碳和氧化铁在高温下生成铁的化学反应方程式 ;
⑸实验一段时间后,观察到B处澄清石灰水变 ; A处红棕色固体变为黑色,小明将所得的黑色固体物质放入足量的稀硫酸中,发现有少量气泡。写出反应的化学方程式 ,说明黑色固体物质 (填字母)。A不含铁 B一定全部是铁 C含有铁
【资料1】已知铁的氧化物均能逐步失去其中的氧,最终被还原为铁。
![]()
【资料2】实验研究表明:该实验得到是四氧化三铁与铁粉的混合物
【实验二】研究后兴趣小组用下图实验研究实验一所得黑色粉末中单质铁的质量分数
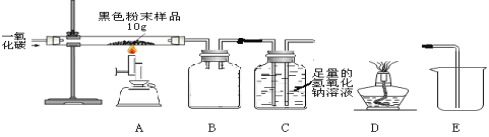
【资料3】氢氧化钠溶液和石灰水类似都可以与二氧化碳反应,但吸收能力比石灰水强
⑹从安全与规范的角度考虑,装置C后面应连接 (选填装置序号)
(7)铁与四氧化三铁的混合物10 g充分反应后,玻璃管中剩余固体(单质铁)的质量为7.6g。请计算10 g黑色粉末中单质铁的质量分数。(写出计算过程,4分)
【答案】⑴26;24⑵c
⑶在尾导管口处放置一点燃的酒精灯
⑷Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
⑸浑浊;Fe+H2SO4==FeSO4+H2↑;c⑹E(7)13%
【解析】
试题分析:⑴在元素周期表中,元素名称左上角的数字为原子的序数,由题中信息可知相对原子质量为55.85;同一原子中,质子数=核外电子数,阳离子是由原子失电子形成,电荷数等于失去的电子数,亚铁离子(Fe2+)的核外电子数为24;⑵人体缺铁元素时易患缺铁性贫血;⑶一氧化碳是有毒气体,排到空气中污染空气,应将尾气点燃或收集,在尾导管口处放置一点燃的酒精灯(其他合理答案也可)⑷一氧化碳和氧化铁在高温下生成铁的化学反应方程式Fe2O3+3CO![]() 2Fe+3CO2⑸二氧化碳能使澄清石灰水变浑浊;铁粉是黑色固体物质,放入足量的稀硫酸中,和硫酸反应生成氢气,产生气泡。Fe+H2SO4==FeSO4+H2↑⑹装置C能收集剩余的一氧化碳,同时吸收二氧化碳,随一氧化碳增多,压强增大,溶液从右侧导管逸出,为避免腐蚀其它物品,应将导管连接装置E,
2Fe+3CO2⑸二氧化碳能使澄清石灰水变浑浊;铁粉是黑色固体物质,放入足量的稀硫酸中,和硫酸反应生成氢气,产生气泡。Fe+H2SO4==FeSO4+H2↑⑹装置C能收集剩余的一氧化碳,同时吸收二氧化碳,随一氧化碳增多,压强增大,溶液从右侧导管逸出,为避免腐蚀其它物品,应将导管连接装置E,
(7)解:设10g混和物中含铁质量为m
Fe3O4+4CO![]() 3Fe+4CO2
3Fe+4CO2
232 3*56
10g-m 7.6g-m
232/(10g-m)=168/(7.6g-m) m=1.3g
Fe%=1.3g/10g=13%