题目内容
【题目】已知铝在空气中会生成一层致密的氧化膜(Al2O3),该氧化膜可与稀盐酸发生反应生成氯化铝和水。实验小组将未打磨的铝片和稀盐酸放入恒容密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图。下列说法正确的是( )

A. 反应过程中没有热量放出
B. 0~50 s,发生稀盐酸与Al的反应
C. 50 s时,溶液中溶质为AlCl3、HCl
D. 100 s~140 s,压强减小是因为不再生成气体
【答案】C
【解析】
A、由温度和时间的变化图可知,反应过程中放出热量,故选项不正确;
B、铝在空气中会生成一层致密的氧化膜(Al2O3),氧化铝和酸反应生成水和氯化铝,压强无明显变化,而铝和酸反应会生成氢气使压强变大,图中0~50 s时气体压强无明显变化,发生的是氧化铝和酸的反应,故选项不正确;
C、50s时有氧化铝和酸反应生成的氯化铝,还有稀盐酸,故选项正确;
D、由题图可知100 s~140 s时反应结束,压强逐渐趋于稳定,故选项不正确。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】某研究小组对过氧化氢溶液制取氧气进行如下探究:
实验一:如图装置可用于多次连续进行氧气的制取和性质的实验。
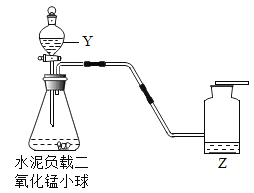
(1)仪器Y的名称是_______。
(2)该反应的化学式表达式:________,二氧化锰在反应中的作用是___。多孔水泥负载二氧化锰小球用于实验时的主要优点是_____,检验氧气已收集满的方法_________。
(3)做氧气的性质实验时,实验不同,Z的作用不同。
①铁丝燃烧。Z为水,其作用是_____。
②蜡烛燃烧。Z为______,其作用是验证蜡烛燃烧生成了二氧化碳。
实验二:探究H2O2质量分数、溶液pH、温度对反应速率的影响
(2)设计如下表实验方案:
实验序号 | H2O2质量分数/% | pH | 温度/℃ | 每分钟气泡数 |
1 | 30 | 5 | 20 | |
2 | 30 | 6 | 20 | |
3 | 30 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
①进行实验1~3的目的是探究________。
②a=_________;b=_________。
实验三:探究制取氧气的适宜催化剂

(3)实验方案如下:
I.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取30粒含MnO2的海藻酸钠微球,采用左下图装置进行实验。改用其他三种微球,分别重复上述实验,得到右下图的锥形瓶内压强随时间变化的曲线图。
①每次实验时,海藻酸钠微球数应相同的原因_________。
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是____。
③从实验曲线看,催化效果较好、反应温和的催化剂是______。
【题目】某同学为了测定实验室中氯酸钾样品的纯度。取2.5克该样品与0.5克二氧化锰混合,加热一段时间后(杂质不参加反应),冷却,称量剩余物质量,重复上述操作,记录数据如下表:
加热时间 | T1 | T2 | T3 | T4 |
剩余物质量 | 2.12 | 2.08 | 2.04 | 2.04 |
①加热到T2时间后,氯酸钾是否已经反应完全?_____
②样品中氯酸钾的质量分数_______
【题目】第七组同学在探究锌、铁、铜三种金属活动性顺序中,又发现影响化学反应的剧烈程度的因素。探究过程如下:
(1)甲同学分别取等量的稀硫酸与足量的相同大小的三种金属进行如右图所示实验。该实验可通过观察是否产生气泡及产生气泡的快慢,判断金属活动性为Zn>Fe>Cu。同时可说明化学反应剧烈程度还与______有关。

(2)乙同学用一只试管,取一次稀硫酸和足量的铜片、铁片、锌片, 通过设计如下的实验方案进行金属活动性顺序的判定。填写下表内容:
实验步骤 | 观察到的现象 |
① 取少量稀硫酸于试管中,插入足量铁片,充分作用 | __________,溶液由无色变为浅绿色 |
② 在①反应后溶液中插入______________,充分作用 | 无明显现象 |
③ 在②所得的溶液中插入______________,充分作用 | ___________,溶液由浅绿色变成无色 |
写出实验步骤③中涉及反应的化学方程式:____________
(3)丙同学认为在乙同学设计的方案中,只要补充一个实验,还可得出Zn>Fe>H>Cu的结论。丙同学要补充的实验是_____。
(4)丁同学认为不必做补充实验,只需在乙同学方案中调整插入金属的顺序,即可得到Zn>Fe>H>Cu的结论,你认为调整后插入金属的实验顺序是__________。