题目内容
在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).
下面是某化学兴趣小组处理回收含铜废料的主要步骤.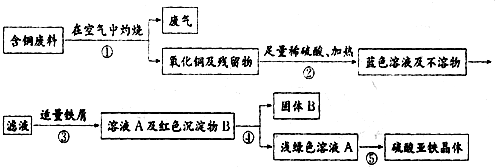
回答下列问题:
(1)溶液A中溶质的化学式是
(2)步骤④的操作方法是
(3)某同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸发生反应
(化学方程式为:2Cu+2H2SO4+O2
2CuSO4+2H2O),该方案明显优于原方案,你认为优点是
(4)方案最后一步所得浅绿色滤液结晶后,会得到硫酸亚铁晶体,可增加经济效益.请写出使“绿矾(硫酸亚铁晶体)”结晶的可能方法:
下面是某化学兴趣小组处理回收含铜废料的主要步骤.

回答下列问题:
(1)溶液A中溶质的化学式是
FeSO4
FeSO4
;(2)步骤④的操作方法是
过滤
过滤
;(3)某同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸发生反应
(化学方程式为:2Cu+2H2SO4+O2
| ||
不产生污染空气的气体和粉尘
不产生污染空气的气体和粉尘
.(4)方案最后一步所得浅绿色滤液结晶后,会得到硫酸亚铁晶体,可增加经济效益.请写出使“绿矾(硫酸亚铁晶体)”结晶的可能方法:
冷却结晶
冷却结晶
(“绿矾(硫酸亚铁晶体)”溶解度随温度升高而增大)分析:(1)由蓝色溶液与铁反应考虑所得溶液中的溶质;
(2)步骤④是分离固液混合物的操作,根据要求可选择适当的分离方法;
(3)对比分析原实验方案,即可知道该方案的明显优点;
(4)根据题意确定“绿矾”结晶的两种方法.
(2)步骤④是分离固液混合物的操作,根据要求可选择适当的分离方法;
(3)对比分析原实验方案,即可知道该方案的明显优点;
(4)根据题意确定“绿矾”结晶的两种方法.
解答:解:(1)铜在空气中灼烧生成黑色固体氧化铜,氧化铜与硫酸反应生成蓝色硫酸铜,与铁屑反应置换出铜,反应方程式为:CuO+H2SO4═CuSO4+H2O; Fe+CuSO4═FeSO4+Cu;故溶液A中溶质的化学式是FeSO4;
(2)加入适量的铁屑,是将硫酸铜中的铜全部置换出来,用过滤法即可分离溶液A和红色固体B;
(3)从环保角度对两套方案的不同部分进行比较,开始方案第一步灼烧会产生污染空气的气体,粉尘,烟雾,由此可知第二个方案更合理;
(4)结晶的方法有:冷却热饱和溶液和蒸发溶剂法,即蒸发结晶和降温结晶.
故答案为:(1)FeSO4 (2)过滤 (3)不产生污染空气的气体和粉尘 (4)冷却结晶
(2)加入适量的铁屑,是将硫酸铜中的铜全部置换出来,用过滤法即可分离溶液A和红色固体B;
(3)从环保角度对两套方案的不同部分进行比较,开始方案第一步灼烧会产生污染空气的气体,粉尘,烟雾,由此可知第二个方案更合理;
(4)结晶的方法有:冷却热饱和溶液和蒸发溶剂法,即蒸发结晶和降温结晶.
故答案为:(1)FeSO4 (2)过滤 (3)不产生污染空气的气体和粉尘 (4)冷却结晶
点评:本题考查通过实验现象,培养学生综合利用所学知识进行分析解题的能力.题型涉及知识面广泛,是一道锻炼能力的好题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2CuSO4
+ 2H2O取一定量溶质的质量分数为10%的稀硫酸(其中含溶质49 g),与铜恰好完全反应,假设其他杂质不反应也不溶解,则反应后硫酸铜溶液中溶质的质量分数是多少?
2CuSO4
+ 2H2O取一定量溶质的质量分数为10%的稀硫酸(其中含溶质49 g),与铜恰好完全反应,假设其他杂质不反应也不溶解,则反应后硫酸铜溶液中溶质的质量分数是多少?