题目内容
早在西汉时期,我国就用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”.求:(1)请写出“湿法炼铜”的化学方程式______.
(2)若用该方法制得铜32g,反应的铁的质量______g,若同时消耗了500g硫酸铜溶液,则该硫酸铜溶液中硫酸铜的质量分数为______%.
【答案】分析:(1)根据书写化学方程式的步骤和质量守恒定律完成;
(2)根据化学方程式进行计算,根据已知量计算未知量;
解答:解:(1)“湿法炼铜”的化学方程式为:CuSO4+Fe═Cu+FeSO4
(2)设制的32g铜,反应的铁的质量为x,消耗硫酸铜的质量为y:
CuSO4+Fe═Cu+FeSO4
160 56 64
y x 32g
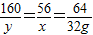
x=28g,y=80g
该硫酸铜溶液中硫酸铜的质量分数为=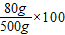 %=16%
%=16%
故答案为:(1)CuSO4+Fe═Cu+FeSO4(2)28g,16%.
点评:本题主要考查了化学方程式的书写和根据化学方程式的计算,要熟练掌握有关的步骤是解决此类问题的关键.
(2)根据化学方程式进行计算,根据已知量计算未知量;
解答:解:(1)“湿法炼铜”的化学方程式为:CuSO4+Fe═Cu+FeSO4
(2)设制的32g铜,反应的铁的质量为x,消耗硫酸铜的质量为y:
CuSO4+Fe═Cu+FeSO4
160 56 64
y x 32g
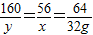
x=28g,y=80g
该硫酸铜溶液中硫酸铜的质量分数为=
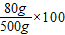 %=16%
%=16%故答案为:(1)CuSO4+Fe═Cu+FeSO4(2)28g,16%.
点评:本题主要考查了化学方程式的书写和根据化学方程式的计算,要熟练掌握有关的步骤是解决此类问题的关键.

练习册系列答案
相关题目