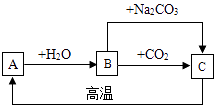
��Ŀ����
����Ŀ��ʵ������һƿ����¶���ڿ����е�����������Һ��ȷ���ѱ��ʣ�ijѧϰС��չ������̽����ȷ������Һ�ijɷ֣�����һ���ӱ��ʵ���Һ�л����������ƣ�
������1�����õ�����������Һ��ȫ�����ʣ����Dz��ֱ��ʣ�
��1����̽��1��ȷ������Һ�����ʵijɷ֣�
ʵ����� | ʵ������ | ʵ����� |
��ȡ������Һ���Թ��У�����Һ�еμ� | ��ɫ�������� | ����Һ���ֱ��ʣ����� |
�ڽ����裨1����Ӧ��Ļ���ᄇ�ã�ȡ�����ϲ���Һ���μ�2��3�η�̪��Һ�� |
��2������˼������������Һ���ʵ�ԭ�����û�ѧ����ʽ��ʾ�����������������Һ�����ܷⱣ�森
��3��������2����δӱ��ʵ�����������Һ�л��յõ��ϴ������������ƹ��壮 ��̽��2�����մ������������ƹ��壮����֪�����������ܽ�����¶������������ԣ�
��ش��������⣺
���Լ�X�� �� ϵ�в���z�в���ڵ������� ��
��̽��1�е����ʼ����̽��2�еij����ᴿ����̼���ƽ�����ת����������Ŀ�IJ�ͬ����˵���� ��
���𰸡�
��1���������Ȼ��ƣ��������ɣ�����Һ���ɫ
��2��2NaOH+CO2=Na2CO3+H2O
��3��Ca��OH��2�����ˣ�ʵ��̽��1�н�̼����ת��Ϊ�Ȼ���Ŀ�����ų����������Ƽ���ĸ��ţ�ʵ��̽��2������Ϊ�˳�ȥ��Ʒ�е����ʶ���̼����ת��Ϊ��Ʒ��������
���������⣺��̽��1��Ҫ�����������Ƶı��ʳ̶ȣ����Լ���������Ȼ�����Һ��ȥ̼���ƣ�Ȼ������̪��Һ����Һ��죬˵���Dz��ֱ��ʣ�����������Ȼ��ƣ��������ɣ�����Һ���ɫ������˼�������������������̼��Ӧ����̼���ƺ�ˮ�����ʣ����2NaOH+CO2=Na2CO3+H2O����̽��2����Ҫ�����������ƣ���Ҫ��ȥ̼���ƣ����Լ�������������Һ������̼��Ƴ������������ƣ�Ȼ����˳�ȥ���������Ca��OH��2 �� ���ˣ�
��Ҫ�����������Ƶı��ʳ̶ȣ���Ҫ�����Ƿ����������ƣ���˳�ȥ̼���Ƶ�ʱ���������������ƣ���Ҫ�����������ƣ����ȥ̼���Ƶ�ʱ���������µ����ʣ����ʵ��̽��1�н�̼����ת��Ϊ�Ȼ���Ŀ�����ų����������Ƽ���ĸ��ţ�ʵ��̽��2������Ϊ�˳�ȥ��Ʒ�е����ʶ���̼����ת��Ϊ��Ʒ�������ƣ�
�����㾫����������Ĺؼ�����������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ������ע�⣺a����ƽ b������ c�����ţ�

����Ŀ���������и������ʣ�ѡ�õķ������Լ�����ȷ���ǣ� ��
���� | ѡ�õķ������Լ� | |
A | �����͵��� | ȼ�ŵ�ľ�� |
B | �ƾ���ʳ�� | ����ζ |
C | �����а��Ǻ�ʳ�� | �۲� |
D | Ӳˮ����ˮ | ����ˮ |
A.A
B.B
C.C
D.D