题目内容
18.如表为元素周期表中某一部分元素的原子结构示意图.请回答下列问题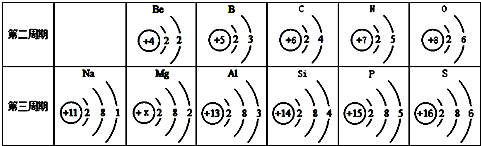
(1)表中镁原子的核电荷数x=12;
(2)表中易失去3个电子的金属元素名称是铝;
(3)地壳中含量最多的金属元素和非金属元素形成的化合物的化学式为Al2O3;
(4)观察上表,同纵行元素的原子具有相同的是B(填字母选项).
A.电子层数 B.最外层电子数 C.化学性质.
分析 根据已有的知识进行分析,核电荷数=核外电子数;铝原子易失去3个电子变成铝离子,根据元素符号以及化学式的书写方法书写有关物质的化学式;同纵行元素的原子具有相同的最外层电子数.
解答 解:(1)核电荷数=核外电子数,的镁原子核外电子数是2+8+2=12,故其核电荷数为12;
(2)铝原子易失去3个电子变成铝离子;
(3)地壳中含量最多的金属元素是铝和非金属元素是氧,形成的化合物为氧化铝,其化学式为Al2O3,
(4)同纵行元素的原子具有相同的最外层电子数.
答案:(1)12;(2)铝;(3)Al2O3;(4)B.
点评 本题考查了元素周期表的应用,完成此题,可以依据元素周期表的意义进行.

练习册系列答案
相关题目
8.下列化学符号与名称相符合的是( )
| A. | 碳酸钠 NaCO3 | B. | 铁离子 Fe2+ | C. | 氧元素 O2 | D. | 干冰 CO2 |
6.下列说法错误的是( )
| A. | 实验室制氧气可不用二氧化锰 | B. | 硫燃烧可发出蓝紫色火焰 | ||
| C. | 氧气具有可燃性 | D. | 氧气的化学性质比较活泼 |
13.下列描述中正确的是( )
| A. | 某粒子核内所含的质子数多于其核外电子数,该粒子一定是阳离子 | |
| B. | 凡是最外层有8个电子的粒子都是稀有气体的原子 | |
| C. | 质子数相同的粒子一定属于同种元素 | |
| D. | 某物质经分析得知只含一种元素,则该物质一定是单质 |
17.人们日常生活离不开金属,高科技新材料的开发和应用也需要金属.
(1)生铁和钢的机械性能不同,钢的性能比铁优越的原因是钢的含碳量比生铁低
(2)锂电池是一种新型的高能电池,其质量轻,电容量大,颇受手机、手提电脑等制造商的青睐.某种锂电池的总反应式为Li+MnO2═LiMnO2,其中化合价发生变化的元素是Li、Mn
(3)根据如图金属应用实例推断,金属具有的物理性质有:导电性;导热性;延展性.

(4)日常使用的金属材料多数属于合金,下表列出了一些常见合金的主要成分和性能.
由上表推断,与组成合金的纯金属相比,合金的优点一般有②④(填序号)
①强度更低;②硬度更高;③熔点更高;④抗腐蚀性更好.
(5)人们每年要从金属矿物资源中提取数以亿吨计的金属.根据所学化学知识,按要求写出一个生成金属的化学方程式Fe+CuSO4=Cu+FeSO4.
(1)生铁和钢的机械性能不同,钢的性能比铁优越的原因是钢的含碳量比生铁低
(2)锂电池是一种新型的高能电池,其质量轻,电容量大,颇受手机、手提电脑等制造商的青睐.某种锂电池的总反应式为Li+MnO2═LiMnO2,其中化合价发生变化的元素是Li、Mn
(3)根据如图金属应用实例推断,金属具有的物理性质有:导电性;导热性;延展性.

(4)日常使用的金属材料多数属于合金,下表列出了一些常见合金的主要成分和性能.
| 合金 | 合金的主要性能 | 主要成分及纯金属的性能 |
| 焊锡 | 熔点183℃ | 锡:熔点232℃;铅:熔点327℃. |
| 硬铝 | 强度和硬度好 | 铝、铜、镁等.硬度小,质软. |
| 不锈钢 | 抗腐蚀性好 | 铁、铬、镍等.纯铁抗锈蚀性能不如不锈钢. |
①强度更低;②硬度更高;③熔点更高;④抗腐蚀性更好.
(5)人们每年要从金属矿物资源中提取数以亿吨计的金属.根据所学化学知识,按要求写出一个生成金属的化学方程式Fe+CuSO4=Cu+FeSO4.
 市场上某钙制剂的说明书如图所示,请仔细阅读,并进行计算.
市场上某钙制剂的说明书如图所示,请仔细阅读,并进行计算.