题目内容
【题目】小昊同学欲通过化学实验验证“质量守恒定律”,进行了下列实验探究。
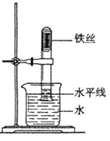
(实验设计)根据实验目的,小昊确定以“铁和硫酸铜溶液”为研究对象,设计的实验装罝如图二所示。
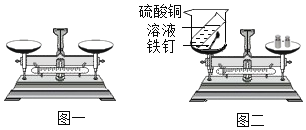
(进行实验)
实验步骤 | 实验现象与记录 | 解释或结论 |
①调零 |
| 如图一所示,调节平衡螺母天平无法平衡的原因是 _________; |
②称量铁钉的质量 | 记录称量数据为5.6g |
|
③称量硫酸铜溶液和烧杯的总质量 | 记录称量数据为113.2g |
|
④铁钉放入盛有硫酸铜溶液的烧杯中 | _____________________________________________ | 该反应的化学方程式为__________________________; |
⑤充分反应后,按如图二方式放好仪器和药品并称量 | 记录称量数据为_____________ | 该反应遵守质量守恒定律 |
(交流反思)(1)下列物质的溶液可以替代硫酸铜溶液直接利用图二装置完成上述实验的是______(填序号)。 A.硫酸铝 B.稀硫酸 C.硝酸银 D.乙醇
(2)实验结束后,过滤步骤⑤烧杯中的混合物,洗涤和干燥后称量固体的质量为5.8g,则该实验中生成铜的质量为___________g。
【答案】游码没归零 铁片上有紫红色物质析出,溶液由蓝色变浅绿色 Fe+CuSO4=FeSO4+Cu 118.8g C 1.6
【解析】
进行实验:
托盘天平调零时应先将游码归零,然后调节平衡螺母;铁钉与硫酸铜溶液反应的实验现象为铁片上有紫红色物质析出,溶液由蓝色变浅绿色;该反应的化学方程式为:Fe+CuSO4=FeSO4+Cu;实验中反应前后质量不变,所以当反应结束后,记录称量数据应为铁钉、烧杯及硫酸铜溶液的总质量为113.2g+5.6g=118.8g;
交流反思:
(1)铁的活动性比铝弱,所以铁钉不能与硫酸铝溶液反应,铁钉也不能与乙醇溶液发生化学变化,所以它们不能用来验证质量守恒定律;铁钉与稀硫酸能反应,但会产生氢气从液体中逸出使得反应前后质量不等,故也不能直接利用图二装置进行验证,铁比银活泼,铁钉能和硝酸银反应生成银和硝酸亚铁,故选硝酸银。
(2)5.6g铁钉与硫酸铜溶液反应后固体质量增加到5.8g,反应后的固体应为铁和铜的混合物,可设生成铜的质量为x,则剩余铁的质量为5.8g-x,参加反应铁的质量为5.6g-(5.8g-x)=x-0.2g,
解:设生成铜的质量为x。
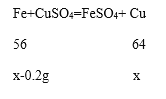
![]()
解得x=1.6g
答:生成铜的质量为1.6g。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】为了研究物质的溶解现象,设计并进行了如下实验。
实验 |
① |
② |
③ |
现象 | 固体完全溶解, 形成紫色溶液 | 固体少量溶解, 形成浅黄色溶液 | 固体完全溶解, 形成棕色溶液 |
(1)设计实验①、②的目的是______。
(2)依据实验②、③的现象,可得出的结论是______。