题目内容
乙醇(C2H5OH)是以高梁、玉米、薯类等为原料,经过发酵、蒸馏制得,属于可再生资源.乙醇在足量的氧气中完全燃烧时生成二氧化碳和水,如果氧气不足,乙醇燃烧可能还有一氧化碳生成.现用下图实验装置进行实验,检验乙醇的燃烧产物中是否有二氧化碳和一氧化碳:(友情提示:CO+CuO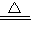 CO2+Cu)
CO2+Cu)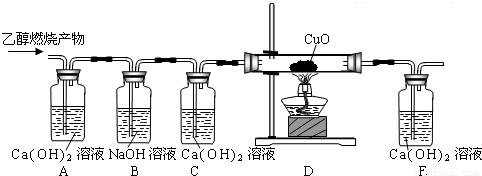
请回答下列问题:
(1)写出乙醇在足量的氧气中完全燃烧的化学方程式______ 2CO2+3H2O
【答案】分析:(1)根据可燃物完全燃烧的规律:可燃物中C元素全部变成二氧化碳、H元素全部生成水,写出乙醇完全燃烧的化学方程式;
(2)装置A用于检验乙醇燃烧是否生成二氧化碳;装置B则用于吸收二氧化碳;装置C用于检验二氧化碳是否已完全吸收;装置D用于把一氧化碳气体转变为二氧化碳;装置E检验装置D排出气体中是否含有二氧化碳;根据以上装置作用的分析,由实验现象判断乙醇燃烧的生成物;
(3)根据化学变化前后元素种类和质量不变,乙醇燃烧生成物二氧化碳、一氧化碳中碳元素质量总和即乙醇中碳元素质量,由乙醇中C、H元素质量比计算出H元素质量,由H元素质量计算生成水的质量.
解答:答:(1)乙醇(C2H5OH)在足量氧气中完全燃烧生成二氧化碳和水;
故选C2H5OH+3O2 2CO2+3H2O;
2CO2+3H2O;
(2)装置A中石灰水变浑浊,可以说明燃烧生成二氧化碳;
装置C中石灰水不浑浊,说明混合气体中二氧化碳已完全吸收,变浑浊则说明前面生成的二氧化碳没有吸收完全,对后面二氧化碳的判断带来影响;
装置E中石灰水变浑浊,说明气体中有二氧化碳;
故答案为:
(3)4.4g二氧化碳中C元素质量=4.4g×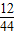 ×100%=1.2g
×100%=1.2g
5.6g一氧化碳中C元素质量=5.6g×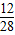 ×100%=2.4g
×100%=2.4g
则燃烧的乙醇中C元素质量=1.2g+2.4g=3.6g
乙醇中C、H元素质量比=24:6=4:1,则乙醇中H元素质量=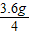 =0.9g
=0.9g
乙醇燃烧生成水的质量=0.9g÷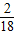 ×100%=8.1g
×100%=8.1g
故答案为:8.1g.
点评:可燃物在氧气充足时完全燃烧,其中C元素生成二氧化碳、H元素生成水;在氧气不足时不完全燃烧,可燃物中的C元素就可能生成二氧化碳或一氧化碳.
(2)装置A用于检验乙醇燃烧是否生成二氧化碳;装置B则用于吸收二氧化碳;装置C用于检验二氧化碳是否已完全吸收;装置D用于把一氧化碳气体转变为二氧化碳;装置E检验装置D排出气体中是否含有二氧化碳;根据以上装置作用的分析,由实验现象判断乙醇燃烧的生成物;
(3)根据化学变化前后元素种类和质量不变,乙醇燃烧生成物二氧化碳、一氧化碳中碳元素质量总和即乙醇中碳元素质量,由乙醇中C、H元素质量比计算出H元素质量,由H元素质量计算生成水的质量.
解答:答:(1)乙醇(C2H5OH)在足量氧气中完全燃烧生成二氧化碳和水;
故选C2H5OH+3O2
 2CO2+3H2O;
2CO2+3H2O;(2)装置A中石灰水变浑浊,可以说明燃烧生成二氧化碳;
装置C中石灰水不浑浊,说明混合气体中二氧化碳已完全吸收,变浑浊则说明前面生成的二氧化碳没有吸收完全,对后面二氧化碳的判断带来影响;
装置E中石灰水变浑浊,说明气体中有二氧化碳;
故答案为:
| 实验现象 | 实验结论 | ||||
| A装置 | C装置 | E装置 | 是否有二氧化碳 | 是否有一氧化碳 | |
| 甲同学 | 有 | 没有 | |||
| 乙同学 | 有 | 可能有 | |||
| 丙同学 | 没有 | 有 | |||
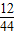 ×100%=1.2g
×100%=1.2g5.6g一氧化碳中C元素质量=5.6g×
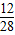 ×100%=2.4g
×100%=2.4g则燃烧的乙醇中C元素质量=1.2g+2.4g=3.6g
乙醇中C、H元素质量比=24:6=4:1,则乙醇中H元素质量=
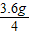 =0.9g
=0.9g乙醇燃烧生成水的质量=0.9g÷
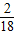 ×100%=8.1g
×100%=8.1g故答案为:8.1g.
点评:可燃物在氧气充足时完全燃烧,其中C元素生成二氧化碳、H元素生成水;在氧气不足时不完全燃烧,可燃物中的C元素就可能生成二氧化碳或一氧化碳.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
随着经济的发展,能源与环境成为人们日益关注的问题.
(1)减少煤、 和天然气等化石燃料的燃烧,会有助于减少二氧化碳的产生.
(2)化石燃料的特点是 (填字母序号).
A.不可再生 B.清洁燃料 C.资源有限 D.新型能源
(3)目前,人们正在利用和开发新能源,如太阳能、核能、地热能、 能等.
(4)我市家庭厨房中的“柴”多数使用天然气,它的主要成分的名称是 ,燃烧的化学方程式是 .
(5)在密闭容器中,将少量乙醇(C2H5OH)置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W.现测得反应前后各物质的质量如下:
①根据质量守恒定律,得出表中x的值为 ;
②根据表中数据,可确定未知物W中所含元素及各组成元素的质量为 .
(1)减少煤、
(2)化石燃料的特点是
A.不可再生 B.清洁燃料 C.资源有限 D.新型能源
(3)目前,人们正在利用和开发新能源,如太阳能、核能、地热能、
(4)我市家庭厨房中的“柴”多数使用天然气,它的主要成分的名称是
(5)在密闭容器中,将少量乙醇(C2H5OH)置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W.现测得反应前后各物质的质量如下:
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水蒸气 | W |
| 反应前的质量/g | 46 | 88 | 0 | 0 | 0 |
| 反应后的质量/g | 0 | 8 | 44 | 54 | x |
②根据表中数据,可确定未知物W中所含元素及各组成元素的质量为