题目内容
【题目】实验室现有高锰酸钾、大理石和37%的浓盐酸,及下列仪器,请回答有关问题:
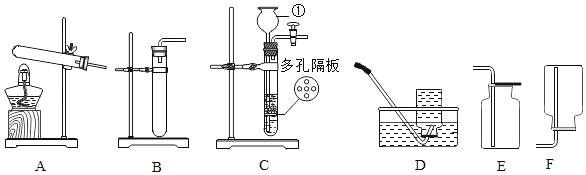
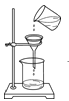
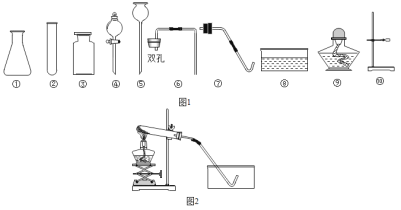
 (1)指出图中仪器的名称:①_____。
(1)指出图中仪器的名称:①_____。
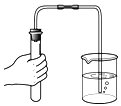
(2)利用上述仪器和药品可以制取氧气,该反应的化学方程式为_____;可选用的发生装置是_____(填字母)。
(3)与装置B相比,C装置的优点是_____(写一个),小明用C装置,取浓盐酸与石灰石反应制取气体,反应的化学方程式为_____;
(查阅资料)①碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O=2NaHCO3
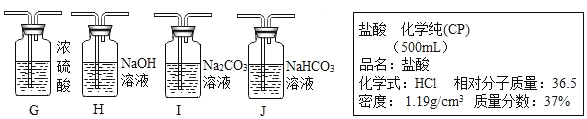
②碳酸氢钠不与二氧化碳反应。如果小明想制的纯净的二氧化碳气体,可将气体依次通过下列试剂_____,并用上图中_____收集。
(4)为了避免用浓盐酸制取二氧化碳,导致气体不纯的现象发生,现取50mL37%浓盐酸稀释成7.4%的稀盐酸,理论上需加水_____mL。
【答案】长颈漏斗 2KMnO4![]() K2MnO4+MnO2+O2↑; A(填字母)。 可以控制反应的进行和停止(或随时添加液体等,合理即可) CaCO3+2HCl=CaCl2+H2O+CO2↑; JG, E。 238。
K2MnO4+MnO2+O2↑; A(填字母)。 可以控制反应的进行和停止(或随时添加液体等,合理即可) CaCO3+2HCl=CaCl2+H2O+CO2↑; JG, E。 238。
【解析】
(1)仪器①的名称是长颈漏斗;
(2)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,该反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;高锰酸钾制氧气的反应物的状态是固体,反应条件是加热,可选用的发生装置为A;
K2MnO4+MnO2+O2↑;高锰酸钾制氧气的反应物的状态是固体,反应条件是加热,可选用的发生装置为A;
(3)①在装置C中,固体药品物放在多孔隔板上,液体药品从长颈漏斗中加入。关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。制取气体时,装置C与装置B相比,装置C的优点是可以控制反应的进行和停止(或随时添加液体等,合理即可);石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②生成的二氧化碳中含有氯化氢气体、水蒸气,根据资料可知:二氧化碳可与碳酸钠溶液反应,且二氧化碳也可与氢氧化钠溶液反应,所以实验须先用碳酸氢钠溶液将氯化氢除去,再用浓硫酸干燥,二氧化碳密度比空气大,然后用向上排空气法收集二氧化碳。如果小明想制取的纯净的二氧化碳气体,可将气体依次通过下列试剂JG,并用上图中E收集;
(4)设:理论上需加水的质量为x。
50ml×1.19g/mL×37%=7.4%(x+50ml×1.19g/mL) x=238g合238mL。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案