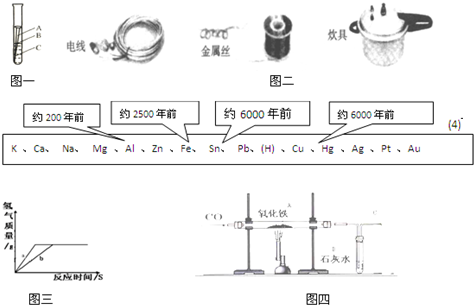
题目内容
下表是不同溶质质量分数的硫酸溶液和氨水与其相应密度的对照表
| 溶液中溶质的质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的密度(20℃)/g?mL | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度(20℃)/g?mL | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
(1)从上表可以看出,硫酸溶液的密度大于水的密度,而氨水的密度则小于水的密度.除此以外,你还能够总结出溶液密度与其溶质的质量分数的变化规律是________.
(2)试从物质定量组成(氨水的溶质为NH3)的角度分析,为什么这两种溶液密度与其溶质的质量分数之间存在这种变化规律?________.
解:(1)硫酸的密度比水大,加的越多,其密度越大,而氨气的密度小于水,加的越多,其密度越接近氨气,所以其密度逐渐减小;
(2)由于H2SO4的相对分子质量98大于H2O的相对分子质量18,随着硫酸溶质质量分数的增大,单位体积硫酸溶液里硫酸分子的数目增加,导致单位体积硫酸溶液的质量增大,所以密度增大.而NH3的相对分子质量小于H2O的相对分子质量,随着氨水溶质质量分数的增大,单位体积氨水里氨分子的数目增加,导致单位体积氨水质量减小,所以密度减小.
故答案为:(1)硫酸的质量分数越大,其密度越大;而氨气,溶质的质量分数越大,其密度逐渐减小;
(2)由于H2SO4的相对分子质量(98)大于H2O的相对分子质量(18),随着硫酸溶质质量分数的增大,单位体积硫酸溶液里硫酸分子的数目增加,导致单位体积硫酸溶液的质量增大,所以密度增大.而NH3的相对分子质量小于H2O的相对分子质量,随着氨水溶质质量分数的增大,单位体积氨水里氨分子的数目增加,导致单位体积氨水质量减小,所以密度减小.
分析:(1)从表中溶质的质量分数的大小和溶液的密度的大小的关系来填空;
(2)从硫酸和氨气的相对分子量角度考虑问题.
点评:本题主要考查的是与溶质的质量分数与化学物质的相对分子量有关的题目,难度一般,是基础题.
(2)由于H2SO4的相对分子质量98大于H2O的相对分子质量18,随着硫酸溶质质量分数的增大,单位体积硫酸溶液里硫酸分子的数目增加,导致单位体积硫酸溶液的质量增大,所以密度增大.而NH3的相对分子质量小于H2O的相对分子质量,随着氨水溶质质量分数的增大,单位体积氨水里氨分子的数目增加,导致单位体积氨水质量减小,所以密度减小.
故答案为:(1)硫酸的质量分数越大,其密度越大;而氨气,溶质的质量分数越大,其密度逐渐减小;
(2)由于H2SO4的相对分子质量(98)大于H2O的相对分子质量(18),随着硫酸溶质质量分数的增大,单位体积硫酸溶液里硫酸分子的数目增加,导致单位体积硫酸溶液的质量增大,所以密度增大.而NH3的相对分子质量小于H2O的相对分子质量,随着氨水溶质质量分数的增大,单位体积氨水里氨分子的数目增加,导致单位体积氨水质量减小,所以密度减小.
分析:(1)从表中溶质的质量分数的大小和溶液的密度的大小的关系来填空;
(2)从硫酸和氨气的相对分子量角度考虑问题.
点评:本题主要考查的是与溶质的质量分数与化学物质的相对分子量有关的题目,难度一般,是基础题.

练习册系列答案
相关题目