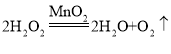题目内容
【题目】实验是实现科学探究的重要途径.请回答以下有关化学实验的问题.
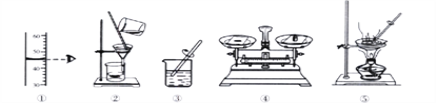
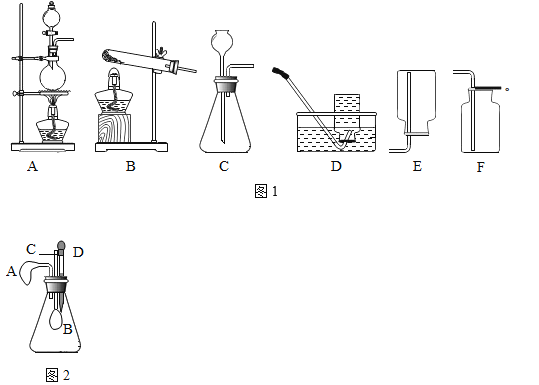
(1)下列实验操作中不正确的是_____(填标号).
①制备气体前检查装置的气密性
②加热实验结束时,用嘴吹灭酒精灯
③将用剩的药品放回原试剂瓶中
④稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中
(2)在实验室里,可用浓盐酸与二氧化锰在加热条件下起反应制取氯气(Cl2),该气体能溶于水,则制取氯气应选择的发生装置和收集装置分别是图1中的_____(填标号).
(3)某兴趣小组设计的趣味小实验装置如图2所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管.用气密性良好的该装置分别进行甲、乙两组实验.实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡.请填写下表中的空白:
锥形瓶中的物质 | 胶头滴管中的物质 | 观察到气球(A、B)的变化 | 有关反应的化学方程式 | |
甲 | 二氧化碳 | 浓氢氧化钠溶液 | _____ | _____ |
乙 | _____ | _____ | A气球胀大 B气球无明显变化 | _____ |
(4)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应.反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯的质量,且气体溶解忽略不计).则参加反应的碳酸钙的质量是多少_____?稀盐酸中溶质的质量分数是多少_____?
【答案】②③ A、F B气球胀大A气球无明显变化 CO2+2NaOH=Na2CO3+H2O 二氧化锰或碳酸钠等 双氧水或盐酸等 2H2O2![]() 2H2O+O2↑(或Na2CO3+2HCl=2NaCl+H2O+CO2↑等) 10g 7.3%
2H2O+O2↑(或Na2CO3+2HCl=2NaCl+H2O+CO2↑等) 10g 7.3%
【解析】
二氧化碳和氢氧化钠溶液反应时生成碳酸钠和水,稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳。
(1)制备气体前要先连接装置再检查装置的气密性;用完酒精灯,必须用灯帽盖灭,不可用嘴去吹灭,否则会失火;用剩的药品要做到“三不一要”:不放回原瓶;不随丢弃,不拿出实验室;要放入指定容器;根据稀释浓硫酸时,先将水放进烧杯里,然后将浓硫酸沿烧杯壁倒入,并用玻璃棒不停搅拌。
(2)实验室中制取氯气所用药品是固态的二氧化锰和液态的浓盐酸,条件是加热,发生装置要选A;氯气能与水反应,不能用排水法收集,其密度比空气大,用向上排空气法收集,故选择收集装置F。
(3)甲:因为氢氧化钠溶液能吸收二氧化碳气体,使锥形瓶中的压强减小,导致B气球膨胀,A气球无明显变化,化学方程式为CO2+2NaOH=Na2CO3+H2O;乙:A气球膨胀,B气球无明显现象,说明锥形瓶中的压强增大,锥形瓶中的物质是二氧化锰或碳酸钠等,胶头滴管中的物质是双氧水或盐酸等。
锥形瓶的物质 | 胶头滴管中的物质 | 观察到气球(A、B)的变化 | 有关反应的 化学方程式 | |
甲 | B气球胀大 A气球无明显变化 | CO2+2NaOH=Na2CO3+H2O | ||
乙 | 二氧化锰或碳酸钠等 | 双氧水或盐酸等 | (或 等) |
(4)解:生成二氧化碳的质量为![]()
设参加反应的碳酸钙的质量为x,稀盐酸中氯化氢的质量为 y
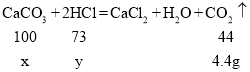
![]()
![]()
稀盐酸中溶质的质量分数为![]()
答:参加反应的碳酸钙为10g;稀盐酸中溶质的质量分数为7.3%。

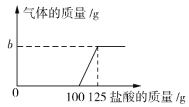
【题目】在实验室中化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验称取试剂19.8 g放入锥形瓶中,加入30.2 g的水,充分振荡,再向锥形瓶中依次滴加25 g盐酸充分反应。测得部分数据与图像如下。请根据有关信息回答问题。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | |
加入盐酸的质量/g | 25 | 25 | 25 | 25 | 25 | 25 |
锥形瓶中物质的质量/g | 75 | 100 | a | 150 | 172.8 | 197.8 |
(1)a的数值为__________,兴趣小组的同学通过实验,得出该试剂已部分变质的结论,其依据是(通过实验数据和图像写出你的分析) _______________________________。
(2)b的数值为____________。
(3)计算该试剂中氢氧化钙的质量分数___________(写出计算过程,结果保留一位小数)。
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A配制50g质量分数为10%的氯化钠溶于 | B去除粗盐中难溶性杂质 |
(1)需要进行的操作步骤有_____(填序号) (2)操作③中玻璃棒的作用是_______ | (1)需要进行的操作步骤有_____(填序号) (2)操作⑤中玻璃棒的作用是_______ |
可供选择的实验基本操作;
| |
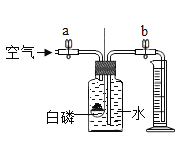
【题目】利用下表所示的实验装置和步骤进行空气中氧气含量的测定[实验前止水夹a、b关闭,容器中的药品(足量)已装入]。下列分析不正确的是
实验装置 | 实验步骤 |
| ①打开a、b,通入空气,当液面下降至某一处,关闭a、b,测得进入量筒中水的体积为V1; ②用强光照射引燃白磷; ③白磷熄灭后冷却至室温,打开b,测得量筒内水的体积为V2。 |
A.步骤①中,液面应下降至燃烧匙以下
B.白磷燃烧的化学方程式为4P + 5O2![]() 2P2O5
2P2O5
C.步骤③观察到集气瓶中的水流入量筒
D.空气中氧气的体积分数为![]()
【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中钠在其中继续燃烧,反应后冷却,瓶底附着有黑色颗粒,同时瓶壁上粘附着白色物质.老师告诉甲同学瓶底附着黑色颗粒是碳单质,但没有告诉瓶壁上粘附着白色物质是什么,让同学们继续探究.
(进行猜想)甲同学认为:白色物质可能是Na2O或Na2CO3
乙同学认为:白色物质可能是NaOH
甲同学立刻认为乙同学的猜想是错误的,其理由是_____.
(查阅资料)氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O═2NaOH
(实验探究)甲同学对白色物质进行实验探究.
实验方案 | 实 验 操 作 | 实验现象 | 结 论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质 为Na2O |
方案2 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量_____溶液 | _____ | 白色物质 是Na2CO3 |
(反思评价)丙同学认为方案1得到的结论不正确,理由是_____.
(得出结论)钠在二氧化碳中燃烧的化学方程式为_____.
通过以上探究,你对燃烧和灭火有什么新的认识,请写出一点._____.