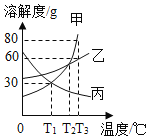
题目内容
【题目】根据下列图示回答问题:
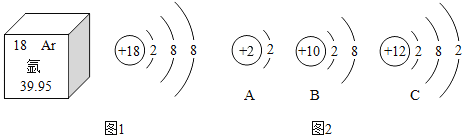
(1)图1中氩元素的相对原子质量是_____,氩原子的质子数是_____。
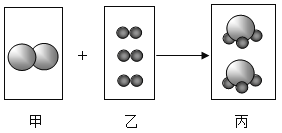
(2)图2中_____(填字母序号)与氩元素化学性质相似;C所示的原子在化学反应中易_____电子,达到稳定结构。
【答案】39.95 18 AB 失去
【解析】
(1)根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为39.95。根据元素周期表中的一格可知,左上角的数字为18,表示原子序数为18;根据原子中原子序数=核电荷数=质子数=核外电子数,则氩原子的质子数是18。
(2)元素的化学性质跟它的原子的最外层电子数目有关,图2中AB都属于稳定结构,与氩元素化学性质相似;C所示的原子最外层电子数为2,小于4个,在化学反应中易失去电子。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】某化学兴趣小组同学以“比较铝和锌的金属活动性强弱”为课题进行探究,下面是小华同学和小明同学探究的主要过程:
(提出问题)铝和锌两种金属,哪一种金属活动性更强?
(实验原理)小华同学利用常温下两种金属与酸反应,测定收集等体积氢气所需的时间,判断金属活动性强弱;小明同学利用金属与盐溶液的反应比较金属活动性强弱。
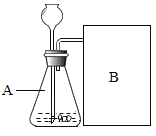
(进行实验)
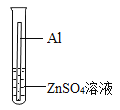
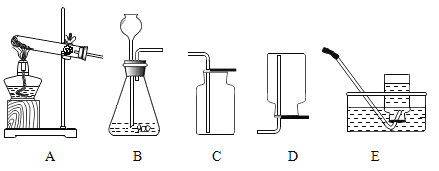
实验一:上图是小华的实验装置图,实验中B处宜采用的气体收集方法是________。
实验编号 | 实验1 | 实验2 |
金属 | 1g表面未氧化的锌粒 | 1g表面打磨过的铝片 |
酸溶液 | 10mL10%的稀盐酸溶液 | 10mL10%的稀硫酸溶液 |
收集20mL氢气所需的时间 | 42s | 64s |
实验结论 | 根据实验现象,得出Zn____Al(填“>” “<”或“=” | |
实验二:小明的实验方案
实验步骤 | 实验现象 | 实验结论 |
将表面打磨过的铝片插入硫酸锌溶液中
| ______ | 金属活动性:Al>Zn |
(分析与评价)
①写出铝与硫酸锌溶液反应的化学方程式_____________;
②两位同学的实验结论刚好相反,你判断______同学实验结论错误,理由是__________。
(实验延伸)为了研究金属与酸反应的其他影响因素,小明用纯锌和纯度为90%的粗锌在相同条件下反应,发现粗锌反应速率更快。
(查阅资料)粗锌中含有铜等与酸不反应的杂质
(猜想与假设)造成粗锌反应速率更快的原因可能是___________。
(设计实验)请设计合理的实验方案验证你的猜想。
实验步骤 | 实验可能的现象及结论 |
__________ | ___________ |