题目内容
【题目】某工厂欲测定铝土矿中Al2O3 的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
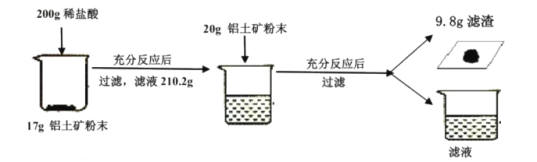
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为_____________。
(2)铝土矿中Al2O3的质量分数为_________________。
(3)根据已知条件列出求解200g稀盐酸中溶质质量(X)的比例式_________。
(4)若将最终所得溶液蒸发掉20. 4g水,所得不饱和溶液中溶质的质量分数为________。
(5)该炼铝厂每天用上述铝土矿170t来生产铝合金,则理论上日产含镁46%的铝镁合金的质量为_____________。
【答案】(1)![]()
(2)60%
(3)![]()
(4)12.5%
(5)103t
【解析】
(1)铝土矿中参与反应的只有氧化铝,氧化铝与盐酸反应生成氯化铝和水,据此书写化学方程式;
故答案为:![]() 。
。
(2)氧化铝与盐酸反应生成氯化铝和水,不会引起溶液质量变化,只有不能反应的杂质,被过滤后才能减少质量,根据上述实验过程,200g稀盐酸与17g铝土矿粉末反应后,滤液再加入20g铝土矿粉末,铝土矿粉末还能溶解,说明在200g稀盐酸加入17g铝土矿粉末中盐酸过量,所以在200g盐酸与17g铝土矿混合溶液反应后过滤,减少的质量为杂质质量=200g+17g-210.2g=6.8g,反应的氧化铝质量=17g-6.2g=10.2g,所以其中氧化铝的质量分数=![]() ;
;
故答案为:60%。
(3)根据(2)中可知铝土矿中氧化铝质量分数为60%,所以20g铝土矿中氧化铝质量=20g×60%=12g,残渣质量=20g-12g=8g,所以过滤后的残渣中有未反应的氧化铝,消耗掉氧化铝的质量=20g-9.8g=10.2g,因此200g盐酸总共消耗氧化铝的质量=17g×60%+10.2g=20.4g,

![]()
故答案为:![]() 。
。
(4)最终溶液质量=230.2g-9.8g=220.4g,此时蒸发20.4g水,溶液质量=220.4g-20.4g=200g,设生成氯化铝的质量为m,

![]() m=25g,溶液溶质质量分数=
m=25g,溶液溶质质量分数=![]() ;
;
故答案为:12.5%。
(5)根据题目要求,铝的含量为100%-46%=54%,根据铝元素质量守恒,铝土矿中铝元素的质量=铝合金中铝元素的质量,设铝合金质量为y,175t×60%×![]() =y×54%,y=103t;
=y×54%,y=103t;
故答案为:103t。