题目内容
 鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小勇同学进行了如下实验.请回答相关问题:
鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小勇同学进行了如下实验.请回答相关问题:(1)他将蛋壳洗净、干燥并捣碎放在烧杯里,然后往烧杯中加入足量盐酸,在蛋壳上很快就有许多小气泡产生,将收集到的气体通入澄清石灰水中,石灰水变浑浊.据此可判断,收集到的气体中含有
二氧化碳
二氧化碳
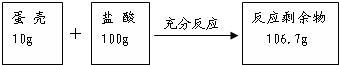
.(2)实验过程和测定的相关实验数据如图所示:
小勇同学根据以上数据求出了蛋壳中碳酸钙的质量分数,请你写出小勇的计算过程.
分析:(1)根据二氧化碳能使澄清的石灰水变浑浊来解答;
(2)根据石灰水增加的质量=气体的质量,计算碳酸钙的质量,进而计算蛋壳中碳酸钙的质量分数.
(2)根据石灰水增加的质量=气体的质量,计算碳酸钙的质量,进而计算蛋壳中碳酸钙的质量分数.
解答:解:(1)使澄清石灰水变浑浊是二氧化碳的特性,因此收集到的气体中含有二氧化碳;
(2)反应前后减少的质量是二氧化碳的质量,二氧化碳被石灰水完全吸收后,石灰水增加的质量也是二氧化碳的质量,
CO2 的质量=10g+100g-106.7g=3.3g
设鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
=
x=7.5g
碳酸钙的质量分数为:
×100%=75%.
故答案为:(1)二氧化碳;
(2)蛋壳中碳酸钙的质量分数为75%.
(2)反应前后减少的质量是二氧化碳的质量,二氧化碳被石灰水完全吸收后,石灰水增加的质量也是二氧化碳的质量,
CO2 的质量=10g+100g-106.7g=3.3g
设鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
| 100 |
| 44 |
| x |
| 3.3g |
碳酸钙的质量分数为:
| 7.5g |
| 10g |
故答案为:(1)二氧化碳;
(2)蛋壳中碳酸钙的质量分数为75%.
点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
相关题目