题目内容
【题目】(1)小明在实验室做加热硫酸铜固体晶体试验的过程中,试管炸裂,请你分析一下可能的原因。_________________;
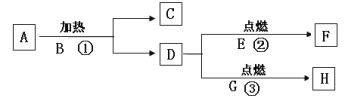
(2)指出图1操作中的错误:(请答出两条)____________________
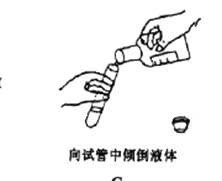
图1
错误的实验操作往往导致不良后果:
(3)用完酒清灯,用嘴去吹灭。后果:____________________;
(4)试管竖立,直接将石块投入试管,后果: ________________;
(5)打开试剂瓶,瓶塞未倒放于桌面,后果: _________________;
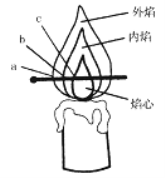
在对蜡烛及其燃烧进行了探究以后,请你填写下列空格:点燃蜡烛,观察到蜡烛的火焰分为三层,分别是____________。一般用蜡烛____________加热,因为温度最高。
【答案】集中加热前试管未预热(试管外壁有水;用灯芯加热;试管口未向下倾斜)瓶塞未倒放 标签未朝手心引发火灾试管破裂试剂被污染外焰,内焰,焰心外焰
【解析】
(1)根据加热硫酸铜晶体实验操作步骤注意事项进行分析解答;
(2)根据倾倒液体的操作,酒精灯、块状药品、使用注意点,火焰结构进行分析解答;
(1)根据加热硫酸铜晶体实验操作,试管炸裂,可能的原因:集中加热前试管未预热(试管外壁有水;用灯芯加热;试管口未向下倾斜,硫酸铜晶体加热会有水蒸气逸出,水蒸气在试管口冷凝为液体,顺着试管回流入底部,有可能使试管受热不均而炸裂);
(2)倾倒液体时,需要注意的是:瓶塞要倒放在桌面上,以防止残留在瓶塞上的污物污染原瓶里的药液;标签向着手心,以防止残留在瓶口的药液流下来污染或腐蚀标签;手拿容器的中上部,并使其稍微倾斜;使瓶口紧挨着容器口,边倒边看,让液体沿器壁缓缓地流入容器底部。图1操作中的错误是瓶塞未倒放,标签未朝手心;
(3)用完酒清灯,用嘴去吹灭,易导致灯内酒精燃烧,发生危险。后果是易引发火灾;
(4)试管竖立,直接将石块投入试管,试管破裂;
(5)打开试剂瓶,瓶塞未倒放于桌面,试剂被污染;
根据图示可知,点燃蜡烛,观察到蜡烛的火焰分为三层,分别是外焰,内焰,焰心;一般用蜡烛外焰加热,因为温度最高。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
【假设】H2O2生成O2的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
【进行实验】右下图是他们进行实验的装置图,气体发生装置中A仪器的名称是_____________,此实验中B处宜采用的气体收集方法是_______ _____。
【实验记录】
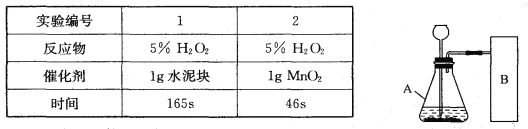
【结论】该探究过程得出的结论是_________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快。若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____ _____是否改变。
【实验拓展】H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入3mL5%的过氧化氢溶液,然后加入少量二氧化锰。 | 缓慢有少量气泡冒出 | |
另取一支试管加入3mL15%的过氧化氢溶液,然后加入少量二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
温度越高,过氧化氢分解的速率越大 |
【题目】现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短探究影响过氧化氢(H2O2)分解速率的因素
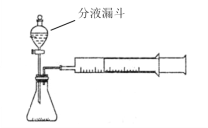
(1)检查此装置气密性的方法是:________________。
(2)甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰0.2g | _____2%H2O2溶液 |
甲组实验Ⅱ | _____ | 二氧化锰0.2g | 10mL 5%H2O2溶液 |
(3)甲、乙两小组得出如图数据。
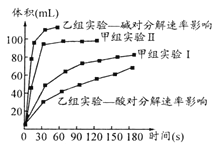
①甲组实验得出的数据可知浓度越大,H2O2分解速率 ___________ ;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快。