题目内容
化学物质之间的反应奥妙无穷,在一次探究活动中,同学们从不同角度对稀硫酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白:
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一
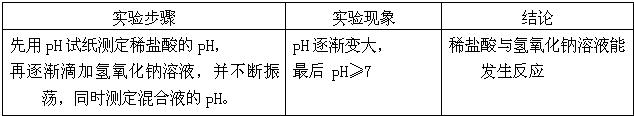
| 实验步骤 | 实验现象 | 结论 |
| 2先向氢氧化钠溶液中滴加酚酞试液 ②向试管内逐滴滴入稀硫酸,并不断振荡 | ________ | 稀硫酸和氢氧化钠溶液发生了反应 |
(2)探究稀硫酸与氢氧化钠溶液是否恰好完全反应
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应,设计了实验方案二
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液 | 若________ | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
解:(1)向氢氧化钠溶液中滴加酚酞试液,氢氧化钠溶液使酚酞试液变成红色,逐滴滴入稀硫酸,并不断振荡,红色逐渐褪去,说明了溶液中无氢氧化钠,稀硫酸和氢氧化钠溶液发生了反应,反应的方程式是:2NaOH+H2SO4=Na2SO4+2H2O;
(2)在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应,取少量上述反应后的溶液于试管中,滴加硫酸铜溶液,若生成蓝色沉淀,则说明了氢氧化钠溶液过量;若无明显现象,则说明无氢氧化钠,剩余溶液可能为中性也可能为酸性,不能说明稀硫酸与氢氧化钠溶液恰好完全反应,原因是:若硫酸过量,加入硫酸铜溶液时也无明显现象,为进一步判定硫酸是否过量,可加入紫色的石蕊试液.
故答为:(1)红色褪去,2NaOH+H2SO4=Na2SO4+2H2O;(2)生成蓝色沉淀,若硫酸过量,加入硫酸铜溶液时也无明显现象,紫色石蕊试液.
分析:(1)根据氢氧化钠溶液能使酚酞试液变成红色分析,根据反应写出反应的方程式;
(2)根据氢氧化钠能与硫酸铜溶液反应生成蓝色沉淀来判断氢氧化钠过量.若无明显现象,则说明无氢氧化钠,剩余溶液可能为中性也可能为酸性.
点评:本题考查了氢氧化钠和硫酸的中和反应,设计实验证明反应是否恰好完全进行以及反应过程中的能量问题,完成此题,可以依据课本已有的知识.所以要求同学们在平时的学习中要加强基础知识的储备,以便能够灵活应用.
(2)在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应,取少量上述反应后的溶液于试管中,滴加硫酸铜溶液,若生成蓝色沉淀,则说明了氢氧化钠溶液过量;若无明显现象,则说明无氢氧化钠,剩余溶液可能为中性也可能为酸性,不能说明稀硫酸与氢氧化钠溶液恰好完全反应,原因是:若硫酸过量,加入硫酸铜溶液时也无明显现象,为进一步判定硫酸是否过量,可加入紫色的石蕊试液.
故答为:(1)红色褪去,2NaOH+H2SO4=Na2SO4+2H2O;(2)生成蓝色沉淀,若硫酸过量,加入硫酸铜溶液时也无明显现象,紫色石蕊试液.
分析:(1)根据氢氧化钠溶液能使酚酞试液变成红色分析,根据反应写出反应的方程式;
(2)根据氢氧化钠能与硫酸铜溶液反应生成蓝色沉淀来判断氢氧化钠过量.若无明显现象,则说明无氢氧化钠,剩余溶液可能为中性也可能为酸性.
点评:本题考查了氢氧化钠和硫酸的中和反应,设计实验证明反应是否恰好完全进行以及反应过程中的能量问题,完成此题,可以依据课本已有的知识.所以要求同学们在平时的学习中要加强基础知识的储备,以便能够灵活应用.

练习册系列答案
相关题目