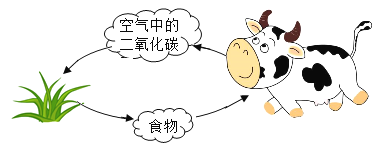
题目内容
【题目】在实验室里模拟用金属铁制备净水剂K2FeO4的流程如下:
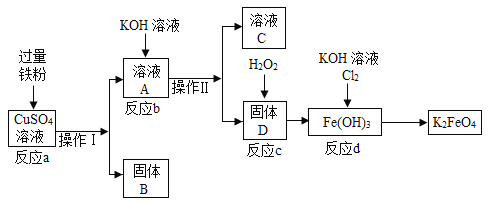
(1)固体B的成分是__________;
(2)操作I和操作Ⅱ是相同的操作,除烧杯、玻璃棒外,还需要的玻璃仪器是________;
(3)若固体D是Fe(OH)2,则反应b可用化学方程式表示为________;
(4)在反应a中,加入过量铁粉的目的是________。
【答案】Cu、Fe 漏斗 ![]() 使硫酸铜完全反应
使硫酸铜完全反应
【解析】
(1)铁和硫酸铜反应生成铜和硫酸亚铁,铁粉过量,故固体B的成分是Cu、Fe;
(2)操作I的名称是过滤,操作I所需要的仪器除烧杯、玻璃棒外,还需要的玻璃仪器是漏斗;
(3)反应b是硫酸亚铁和氢氧化钾反应生成硫酸钾和氢氧化亚铁白色沉淀,化学方程式:![]() ;
;
(4)在反应a中,加入过量铁粉的目的是:使硫酸铜完全反应。

 阅读快车系列答案
阅读快车系列答案【题目】在老师的指导下,小华和小明利用如图1所示装置对氯酸钾制氧气进行了深人的探究学习。
资料:
①氯酸钾的熔点约为356°C,二氧化锰的分解温度约为535°C。用酒精灯给物质加热,受热物质的温度一般约为400°C左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器测得氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下。
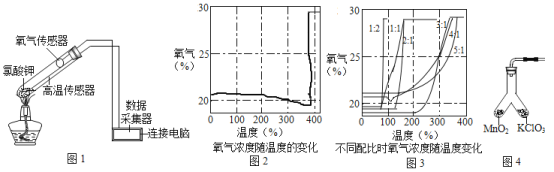
请回答下列问题:
(1)分析图2,氯酸钾分解温度_____(填“高于”、“等于”或“低于”)其熔点。
(2)分析图2,在氯酸钾分解前,传感器测得氧气浓度降低的可能原因是_________。
(3)分析图3,氯酸钾分解温度随物质配比变化的规律是_______。
(4)为证实二氧化锰的催化作用,小华利用如图4装置进行如下表所示的实验:
步骤 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 检查装置气密性 | ||
Ⅱ | 分别在“Y"形管两侧支管中加入少量二氧化锰和氯酸钾,塞紧橡皮塞。 | 没有明显现象 | |
Ⅲ | 分别用酒精灯先后加热二氧化锰氯酸钾,用带火星木条放在导管口。 | 加热左侧支管,可观察 到________,加热右侧支管,可观察到________。 | 二氧化锰受热不分解;氯酸钾受热较长时间后分解。 |
Ⅳ | 冷却后, 将“Y” 形管左侧支管中部分二氧化锰混人右侧支管:中,振荡“Y”形管加热,用带火星木条放在导管口。 | 加热时间段与步骤Ⅲ木条很快复燃 | 用化学方式表示_______。 |
请回答:
①完善上述表格。
②步骤IV中,将二氧化锰混人右侧支管有余热的氯酸钾中的操作方法是_________。
③小华认为根据步骤IV的实验现象就能说明二氧化锰是氯酸钾分解的催化剂。但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的______和_________不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论。