题目内容
将25g石灰石(主要成分是CaCO3)放入73g稀盐酸中(石灰石中的杂质不跟盐酸反应,也不溶于水)恰好完全反应,生成8.8g二氧化碳气体.试求:
(1)石灰石中碳酸钙的质量分数为______;
(2)稀盐酸中溶质的质量分数为______:
(3反应后溶液中溶质的质量分数为______.
解:设石灰石中碳酸钙的质量为x,稀盐酸中溶质的质量为y,生成氯化钙的质量为z.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
x y z 8.8g
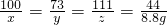
解得:x=20g y=14.6g z=22.2g
(1)石灰石中碳酸钙的质量分数为: ;
;
(2)稀盐酸中溶质的质量分数为: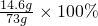 =20%
=20%
(3反应后溶液中溶质的质量分数为: =26.4%.
=26.4%.
答:(1)石灰石中碳酸钙的质量分数为80%;(2)稀盐酸中溶质的质量分数为20%;3)反应后溶液中溶质的质量分数为26.4%.
分析:根据碳酸钙与盐酸反应的化学方程式,由生成的二氧化碳的质量求出碳酸钙、盐酸溶液中的溶质、生成的氯化钙的质量,在计算出石灰石中碳酸钙的质量分数、稀盐酸中溶质的质量分数和生成氯化钙的质量,进而计算出反应后溶液中溶质的质量分数.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,在计算时,要正确地根据质量守恒定律计算反应的溶液的质量,难度较大.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
x y z 8.8g
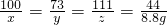
解得:x=20g y=14.6g z=22.2g
(1)石灰石中碳酸钙的质量分数为:
 ;
;(2)稀盐酸中溶质的质量分数为:
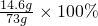 =20%
=20%(3反应后溶液中溶质的质量分数为:
 =26.4%.
=26.4%.答:(1)石灰石中碳酸钙的质量分数为80%;(2)稀盐酸中溶质的质量分数为20%;3)反应后溶液中溶质的质量分数为26.4%.
分析:根据碳酸钙与盐酸反应的化学方程式,由生成的二氧化碳的质量求出碳酸钙、盐酸溶液中的溶质、生成的氯化钙的质量,在计算出石灰石中碳酸钙的质量分数、稀盐酸中溶质的质量分数和生成氯化钙的质量,进而计算出反应后溶液中溶质的质量分数.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,在计算时,要正确地根据质量守恒定律计算反应的溶液的质量,难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
