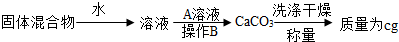题目内容
 某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ.第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的
Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中,不合理的是
甲:适量稀盐酸.乙:过量KOH溶液.丙:适量Ba(OH)2溶液.丁:适量CaCl2溶液.
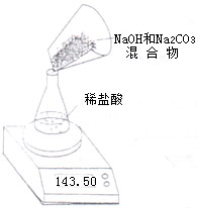
Ⅱ.第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶质量 | 41.20 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第一次称量的质量 | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第二次称量的质量 | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物后,第三次称量的质量 | 148.30 |
(2)混合物中Na2CO3的质量分数为
Ⅲ.第三组选用另一种方案测定NaOH和Na2CO3的混合物(mg)中Na2CO3的质量分数,其操作流程如下:
固体混合物
| 水 |
| ||
| 操作B |
| ||
| 称量 |
(1)A是
(2)B操作的名称是
(3)计算混合物中Na2CO3的质量分数.(写出计算步骤)
分析:I.分析所提供的甲、乙、丙、丁四种试剂与混合溶液发生反应的情况,根据除去混合物中杂质的要求,判断出不适合用于除去杂质碳酸钠的试剂;
II.利用碳酸钠可与盐酸反应放出二氧化碳,而氢氧化钠与盐酸反应生成氯化钠和水而无气体产生,可通过测定放出气体二氧化碳的质量可计算混合物中碳酸钠的质量,从而求得混合物样品中碳酸钠的质量分数;
III.利用只能与碳酸钠发生反应而生成碳酸钡沉淀的试剂,加入该试剂完全反应后过滤,通过所得沉淀质量利用反应的化学方程式,计算混合物中碳酸钠的质量,从而求得混合物样品中碳酸钠的质量分数.
II.利用碳酸钠可与盐酸反应放出二氧化碳,而氢氧化钠与盐酸反应生成氯化钠和水而无气体产生,可通过测定放出气体二氧化碳的质量可计算混合物中碳酸钠的质量,从而求得混合物样品中碳酸钠的质量分数;
III.利用只能与碳酸钠发生反应而生成碳酸钡沉淀的试剂,加入该试剂完全反应后过滤,通过所得沉淀质量利用反应的化学方程式,计算混合物中碳酸钠的质量,从而求得混合物样品中碳酸钠的质量分数.
解答:解:I.甲试剂稀盐酸既能与碳酸钠反应也可与氢氧化钠反应,不能达到除去NaOH溶液中Na2CO3的目的;乙试剂KOH溶液既不能与碳酸钠反应也不能与氢氧化钠反应,不能达到除去NaOH溶液中Na2CO3的目的;丙试剂Ba(OH)2溶液可与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,因此加入适量Ba(OH)2溶液充分反应后过滤,可以除去NaOH溶液中Na2CO3;丁试剂氯化钙与碳酸钠反应生成的氯化钠成为新的杂质,不能达到除去NaOH溶液中Na2CO3的目的;
II.(1)稀盐酸与氢氧化钠反应生成氯化钠和水,与碳酸钠反应生成氯化钠、水和二氧化碳,反应化学方程式为NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)根据质量守恒定律,生成二氧化碳的质量=141.20g+9.30g-148.30g=2.20g;
设混合物样品中的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.20g
=
x=5.30g
混合物中Na2CO3的质量分数=
×100%≈57%
III.(1)由于氯化钡、氢氧化钡、硝酸钡等溶液都可与碳酸钠反应生成碳酸钡沉淀,因此它们都可能用作A溶液;为检验所加入的氯化钠溶液过量,可向过滤后所得澄清的滤液中滴加碳酸钠溶液,观察到有白色沉淀生成,说明所加入的氯化钡溶液过量;
(2)经过操作B后溶液中的沉淀碳酸钡与溶液分离,因此操作B应为过滤操作;该操作过程需要使用的玻璃仪器有:漏斗、烧杯、玻璃棒;
故答案为:
I.甲、乙、丁;
II.(1)NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑;(2)57%;
III.(1)BaCl2;向澄清的滤液中滴加碳酸钠溶液,有白色沉淀产生;(2)过滤;漏斗、烧杯、玻璃棒;
(3)设混合物中Na2CO3的质量为x
Na2CO3+BaCl2═2NaCl+BaCO3↓
106 197
x a g
=
x=
g
混合物中Na2CO3的质量分数=
×100%=
×100%
答:混合物中Na2CO3的质量分数为
×100%.
II.(1)稀盐酸与氢氧化钠反应生成氯化钠和水,与碳酸钠反应生成氯化钠、水和二氧化碳,反应化学方程式为NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)根据质量守恒定律,生成二氧化碳的质量=141.20g+9.30g-148.30g=2.20g;
设混合物样品中的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.20g
| 106 |
| 44 |
| x |
| 2.20g |
混合物中Na2CO3的质量分数=
| 5.30g |
| 9.30g |
III.(1)由于氯化钡、氢氧化钡、硝酸钡等溶液都可与碳酸钠反应生成碳酸钡沉淀,因此它们都可能用作A溶液;为检验所加入的氯化钠溶液过量,可向过滤后所得澄清的滤液中滴加碳酸钠溶液,观察到有白色沉淀生成,说明所加入的氯化钡溶液过量;
(2)经过操作B后溶液中的沉淀碳酸钡与溶液分离,因此操作B应为过滤操作;该操作过程需要使用的玻璃仪器有:漏斗、烧杯、玻璃棒;
故答案为:
I.甲、乙、丁;
II.(1)NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑;(2)57%;
III.(1)BaCl2;向澄清的滤液中滴加碳酸钠溶液,有白色沉淀产生;(2)过滤;漏斗、烧杯、玻璃棒;
(3)设混合物中Na2CO3的质量为x
Na2CO3+BaCl2═2NaCl+BaCO3↓
106 197
x a g
| 106 |
| 197 |
| x |
| a g |
| 106a |
| 197 |
混合物中Na2CO3的质量分数=
| ||
| m |
| 106a |
| 197m |
答:混合物中Na2CO3的质量分数为
| 106a |
| 197m |
点评:检验两种溶液反应后其中一种溶液是否过量,通常可采取向反应后的澄清溶液中再加入另一种反应物溶液,观察是否继续反应产生沉淀而判断.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
实验测知久储的某NaOH固体中含有水的质量分数为3.5%,含Na2CO3的质量分数为6.5%.若取质量为ag的此样品加入到含HCl质量为bg的稀盐酸(过量)中,完全反应后加入含NaOH质量为cg的NaOH溶液,恰好中和残余的盐酸,则所得溶液蒸干时得到晶体质量可能为( )
| A、1.3ag | B、1.6bg | C、1.32ag+1.46cg | D、1.39ag+1.46cg |
 某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH固体中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH固体中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ,第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是
甲:适量稀盐酸 乙:过量KOH溶液 丙:适量Ba(OH)2溶液 丁:适量CaCl2溶液.
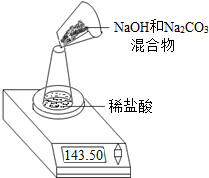
Ⅱ,第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:则混合物中Na2CO3的质量分数为
| 称量项目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 148.30 |

(1)A是
(2)B操作的名称是
(3)混合物中Na2CO3的质量分数为