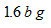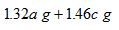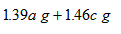题目内容
实验测知久储的某NaOH固体中含有水的质量分数为3.5%,含Na2CO3的质量分数为6.5%.若取质量为ag的此样品加入到含HCl质量为bg的稀盐酸(过量)中,完全反应后加入含NaOH质量为cg的NaOH溶液,恰好中和残余的盐酸,则所得溶液蒸干时得到晶体质量可能为( )
| A、1.3ag | B、1.6bg | C、1.32ag+1.46cg | D、1.39ag+1.46cg |
分析:所得溶液蒸干时得到晶体为氯化钠,由质量守恒定律可知,氯化钠中的氯元素的质量等于稀盐酸中氯元素的质量.
解答:解:由质量守恒定律可知,设所得溶液蒸干时得到晶体质量可能为X,反应前后氯元素的质量为
bg×
=x×
X=1.6bg
故选B.
而从钠元素守恒的角度考虑则有
原样品中钠所对应的氯化钠的质量为6.5%×a×
×100%(这是碳酸钠对应的氯化钠)×
+(1-6.5%-3.5%)×a×
×100%×
(这是氢氧化钠对应的氯化钠)=1.39ag.
而和盐酸反应的加入的氢氧化钠对应的氯化钠的质量为c×
×100%×
=1.46cg
故生成的氯化钠总质量为1.39ag+1.46cg.
故D正确.
故选BD.
bg×
| 35.5 |
| 36.5 |
| 35.5 |
| 58.5 |
X=1.6bg
故选B.
而从钠元素守恒的角度考虑则有
原样品中钠所对应的氯化钠的质量为6.5%×a×
| 23×2 |
| 106 |
| 58.5 |
| 23 |
| 23 |
| 40 |
| 58.5 |
| 23 |
而和盐酸反应的加入的氢氧化钠对应的氯化钠的质量为c×
| 23 |
| 40 |
| 58.5 |
| 23 |
故生成的氯化钠总质量为1.39ag+1.46cg.
故D正确.
故选BD.
点评:本题是巧妙的运用化学中的基本思想质量守恒思想,通过氯元素质量守恒有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.

练习册系列答案
相关题目