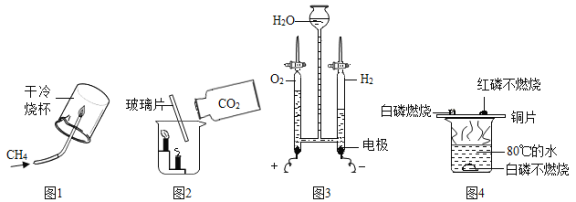
题目内容
【题目】现有以下装置、仪器和药品。请根据要求回答问题:
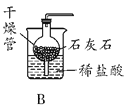
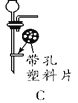
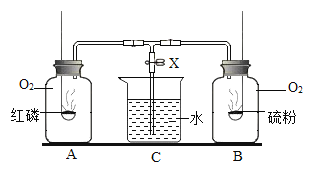
![]()
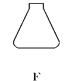

(1)写出仪器的名称:F________。
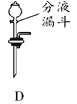
(2)图A的实验室制氧气装置有两处错误,请改正错误 __________;__________。
(3)写出装置B中反应的化学方程式__________________;
若把H与B组合,则该装置的优点是______________。
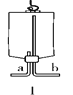
(4)请你从“C到H”中选择仪器_________(填序号),组装一个与HB组合优点相同的装置,该装置用锌粒和稀硫酸反应制备H2,化学方程式是:__________;若用图Ⅰ所示医用塑料袋排空气法收集H2,则H2导入端为____(填“a”或“b”)。
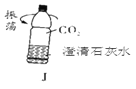
(5)用图J所示矿泉水瓶可以证明CO2与澄清石灰水确实发生了反应,所观察到的现象是________。
【答案】锥形瓶 试管口应向下略倾斜 试管口要放一团棉花。 CaCO3 +2HCl== CaCl2 + H2O+CO2↑ 可随时控制反应的发生或停止。 CEH、 Zn + H2SO4 = ZnSO4 + H2↑ b 澄清石灰水变浑浊、矿泉水瓶变瘪(或变扁)
【解析】
(1)据图可知仪器F是锥形瓶;
(2)固体加热制取气体时为防止冷凝水回流炸裂试管,必须试管口向下倾斜;同时实验室用高锰酸钾制取O2时,高锰酸钾颗粒容易随气流进入导气管,所以必须在试管口放一团棉花,所以两处错误改正为:试管向下倾斜;试管加棉花团;
(3)石灰石主要成分碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;把H与B组合后,打开弹簧夹,固体和液体接触产生气体,关闭弹簧夹后试管内气压增大,酸被压入长颈漏斗,石灰石块状固体就留在干燥管中的带孔塑料板上从而和稀盐酸分离反应停止;
(4)固体和液体分离,反应即可停止,所以要使该反应停止,可以选择CEH组合;锌和硫酸反应生成硫酸锌和氢气,反应方程式是:Zn+H2SO4=ZnSO4+H2↑;用图Ⅰ所示医用塑料袋排空气法收集H2,则H2导入端为b,因为氢气的密度比空气的密度小;
(5)用图J所示矿泉水瓶可以证明CO2能溶于水且能与水反应的现象是:紫色变红色,塑料瓶变瘪。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】阅读下面科普短文(原文作者:王龙飞等,有删改)。
纯净的臭氧在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。
生产中大量使用的臭氧通常由以下方法制得。

臭氧处理饮用水。早在19世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。
臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的15倍之多。
臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表1所示。
表1 臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2mg/L) | 二次污染 | 投资成本 (900m3设备) | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | <5min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | >30min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题。
(1)已知一个臭氧分子由三个氧原子构成,臭氧的化学式为___________。
(2)臭氧处理饮用水时,利用了臭氧的___________(填“物理”或“化学”)性质。
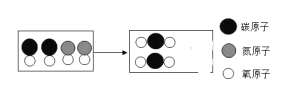
(3)臭氧转化为氧气的微观示意图如下,请在方框中补全相应微粒的图示。_________

(4)臭氧与氯气相比,消毒速度更快的是___________。
(5)下列关于臭氧的说法中,正确的是___________。
A. 臭氧的漂白作用比氯气强
B. 由氧气制得臭氧的过程中,既有物理变化也有化学变化
C. 臭氧在生产生活中有很多用途,对人类有益无害
D. 臭氧稳定性差,不利于储存,其应用可能会受到限制