题目内容
(2012?通州区一模)现有如图所示的下列实验装置.回答问题:
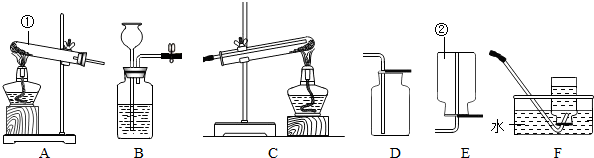
(1)仪器①的名称是
(2)若用氯酸钾和二氧化锰的混合物来制氧气,反应方程式为
(3)质量分数为5%的医用双氧水在常温下难分解;但在双氧水溶液中加入铁锈,就会迅速分解.
【提出问题】铁锈能否起到类似MnO2的催化剂作用呢?
【猜想】Ⅰ:铁锈不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ:铁锈参与反应产生O2,反应前后质量和化学性质发生了改变;

Ⅲ:铁锈是该反应的催化剂,反应前后
【实验】用天平称量0.2g铁锈,取5mL5%的双氧水于试管中,进行如下实验:
填写下表:
步骤①的目的是
【拓展】要探究步骤⑤得到的固体的某一化学性质,你设计的另一简单的实验是

(1)仪器①的名称是
试管
试管
;仪器②的一种用途是收集或贮存气体
收集或贮存气体
.(2)若用氯酸钾和二氧化锰的混合物来制氧气,反应方程式为
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;可选用的发生装置和收集装置分别是
| ||
| △ |
A
A
、D或F
D或F
(填写序号).(3)质量分数为5%的医用双氧水在常温下难分解;但在双氧水溶液中加入铁锈,就会迅速分解.
【提出问题】铁锈能否起到类似MnO2的催化剂作用呢?
【猜想】Ⅰ:铁锈不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ:铁锈参与反应产生O2,反应前后质量和化学性质发生了改变;

Ⅲ:铁锈是该反应的催化剂,反应前后
质量和化学性质不变
质量和化学性质不变
.【实验】用天平称量0.2g铁锈,取5mL5%的双氧水于试管中,进行如下实验:
填写下表:
| 步骤③现象 | 步骤⑥结果 | 结论 |
| 有气泡冒出;带火星的木条复燃. | 铁锈的质量仍为0.2 g 铁锈的质量仍为0.2 g |
猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立. |
与步骤③对比
与步骤③对比
;步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、玻璃棒
玻璃棒
.【拓展】要探究步骤⑤得到的固体的某一化学性质,你设计的另一简单的实验是
取适量固体放于试管,然后倒入稀盐酸,若固体溶解,溶液变为黄色,说明氧化铁与稀盐酸可反应
取适量固体放于试管,然后倒入稀盐酸,若固体溶解,溶液变为黄色,说明氧化铁与稀盐酸可反应
(包括实验操作、现象和结论).分析:(1)根据常用仪器的名称和用途进行分析;
(2)根据氯酸钾分解的反应原理书写方程式,氯酸钾受热生成氧气,属于“固体加热型”,再依据氧气的密度和溶解性选择收集装置;
(3)根据催化剂的特点“一变两不变”(即在反应中能改变化学反应速率,而本身的质量和化学性质不变)分析解答;步骤①的目的是与③对比,研究铁锈是否改变化学反应速率;过滤用到的仪器有铁架台、烧杯、漏斗、玻璃棒;根据铁锈的主要成分是氧化铁,结合题意及氧化铁的化学性质设计实验.
(2)根据氯酸钾分解的反应原理书写方程式,氯酸钾受热生成氧气,属于“固体加热型”,再依据氧气的密度和溶解性选择收集装置;
(3)根据催化剂的特点“一变两不变”(即在反应中能改变化学反应速率,而本身的质量和化学性质不变)分析解答;步骤①的目的是与③对比,研究铁锈是否改变化学反应速率;过滤用到的仪器有铁架台、烧杯、漏斗、玻璃棒;根据铁锈的主要成分是氧化铁,结合题意及氧化铁的化学性质设计实验.
解答:解:(1)根据常用仪器的名称和用途可知:仪器①是试管,②是集气瓶,集气瓶的主要作用是收集或贮存气体;
故答案为:试管; 收集或贮存气体;
(2)氯酸钾在二氧化锰作催化剂、加热的条件下生成氯化钾和氧气,方程式是2KClO3
2KCl+3O2↑;氯酸钾受热生成氧气,属于“固体加热型”,故选发生装置A,氧气的密度比空气大且不易溶于水,所以可用向上排空气法和排水法收集;
故答案为:2KClO3
2KCl+3O2↑; A; D 或F;
(3)根据题意:铁锈是该反应的催化剂,根据催化剂的特点“一变两不变”,所以其质量和化学性质在反应前后不变,其质量仍为0.2g,步骤①的目的是与③对比,研究铁锈是否改变化学反应速率;过滤用到的仪器有铁架台、烧杯、漏斗、玻璃棒;氧化铁可与还原性物质发生反应,还可与稀盐酸或稀硫酸反应,相比之下,与酸的反应简单易行,而与还原性物质要在加热或高温条件下进行,所以可取适量固体放于试管,然后倒入稀盐酸,若固体溶解,溶液变为黄色,说明氧化铁与稀盐酸可反应;
故答案为:
质量和化学性质不变;
铁锈的质量仍为0.2 g;
与步骤③对比; 玻璃棒; 取适量固体放于试管,然后倒入稀盐酸,若固体溶解,溶液变为黄色,说明氧化铁与稀盐酸可反应.
故答案为:试管; 收集或贮存气体;
(2)氯酸钾在二氧化锰作催化剂、加热的条件下生成氯化钾和氧气,方程式是2KClO3
| ||
| △ |
故答案为:2KClO3
| ||
| △ |
(3)根据题意:铁锈是该反应的催化剂,根据催化剂的特点“一变两不变”,所以其质量和化学性质在反应前后不变,其质量仍为0.2g,步骤①的目的是与③对比,研究铁锈是否改变化学反应速率;过滤用到的仪器有铁架台、烧杯、漏斗、玻璃棒;氧化铁可与还原性物质发生反应,还可与稀盐酸或稀硫酸反应,相比之下,与酸的反应简单易行,而与还原性物质要在加热或高温条件下进行,所以可取适量固体放于试管,然后倒入稀盐酸,若固体溶解,溶液变为黄色,说明氧化铁与稀盐酸可反应;
故答案为:
质量和化学性质不变;
铁锈的质量仍为0.2 g;
与步骤③对比; 玻璃棒; 取适量固体放于试管,然后倒入稀盐酸,若固体溶解,溶液变为黄色,说明氧化铁与稀盐酸可反应.
点评:本题综合性较强,既考查了装置的选取,方程式的书写,还考查了对于催化剂概念的理解,氧化铁的化学性质等知识,能很好的考查学生对知识的理解和应用.

练习册系列答案
相关题目
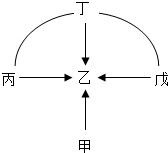 (2012?通州区一模)30、甲、乙、丙、丁、戊是初中化学常见的物质,其相互反应关系如图,“→”表示转化关系,“-”表示相互反应关系.请根据下列情况回答问题:
(2012?通州区一模)30、甲、乙、丙、丁、戊是初中化学常见的物质,其相互反应关系如图,“→”表示转化关系,“-”表示相互反应关系.请根据下列情况回答问题: