题目内容
石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用20g石灰石样品,把100g稀盐酸分5次加入样品中(样品中除碳酸钙外,其余的成分既不与酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得到的实验数据如下表:
稀盐酸的用量 | 第一次加入20g | 第二次加入20g | 第三次加入20g | 第四次加入20g | 第五次加入20g |
| 剩余固体的质量 | 15g | 10g | 5g | 4g | m |
(2)该石灰石样品中碳酸钙的质量分数______;
(3)计算该稀盐酸的溶质质量分数(结果精确到0.1%).
解:(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙15g-10g=5g;第四次中仅减少了5g-4g=1g,没有减少到5g,说明此时碳酸钙已完全反应,样品中含有4g杂质,即m的数值为4g.
(2)样品中碳酸钙的质量分数为 =80%
=80%
(3)解:根据分析可知,每5g碳酸钙对应20g的盐酸溶液,所以计算时可以是5g碳酸钙对应20g盐酸(第一次的情况),也可以是10g碳酸钙对应40g盐酸的情况(第二次的情况),当然也可以是15g碳酸钙对应60g盐酸的情况(第三次的情况).本题计算我以第二次计算为准.
设与10克碳酸钙反应的HCl的质量为x
CaCO3+2 HCl═CaCl2+H2O+CO2↑
100 73
10g x

X=7.3g
所以稀盐酸中溶质的质量分数为: ×100%=18.25%.
×100%=18.25%.
故答案为:(1)4g;(2)80%;
(3)18.25%.
答:(2)样品中碳酸钙的质量分数为80% (3)稀盐酸中溶质的质量分数为18.25%.
分析:(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙15g-10g=5g;第四次中仅减少了5g-4g=1g,没有减少到5g,说明此时碳酸钙已完全反应,样品中含有4g杂质,即m的数值为4g.
(2)由样品质量和杂质质量就可以计算出样品中碳酸钙的质量分数.
(3)根据反应的化学方程式,由参加反应的碳酸钙的质量计算盐酸完全反应时消耗的HCl的质量,利用 ×100%计算该稀盐酸的质量分数;根据实验数据,前三次所加入的稀盐酸都完全发生了反应,在计算稀盐酸的溶质质量分数时可使用前三次的实验数据.
×100%计算该稀盐酸的质量分数;根据实验数据,前三次所加入的稀盐酸都完全发生了反应,在计算稀盐酸的溶质质量分数时可使用前三次的实验数据.
点评:根据反应进行参加反应的溶液溶质质量分数计算时,一定要选取溶液中溶质完全反应时的数据计算溶液中溶质的质量,这样求得的溶质质量才是溶液中全部溶质的质量.
(2)样品中碳酸钙的质量分数为
 =80%
=80%(3)解:根据分析可知,每5g碳酸钙对应20g的盐酸溶液,所以计算时可以是5g碳酸钙对应20g盐酸(第一次的情况),也可以是10g碳酸钙对应40g盐酸的情况(第二次的情况),当然也可以是15g碳酸钙对应60g盐酸的情况(第三次的情况).本题计算我以第二次计算为准.
设与10克碳酸钙反应的HCl的质量为x
CaCO3+2 HCl═CaCl2+H2O+CO2↑
100 73
10g x

X=7.3g
所以稀盐酸中溶质的质量分数为:
 ×100%=18.25%.
×100%=18.25%.故答案为:(1)4g;(2)80%;
(3)18.25%.
答:(2)样品中碳酸钙的质量分数为80% (3)稀盐酸中溶质的质量分数为18.25%.
分析:(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙15g-10g=5g;第四次中仅减少了5g-4g=1g,没有减少到5g,说明此时碳酸钙已完全反应,样品中含有4g杂质,即m的数值为4g.
(2)由样品质量和杂质质量就可以计算出样品中碳酸钙的质量分数.
(3)根据反应的化学方程式,由参加反应的碳酸钙的质量计算盐酸完全反应时消耗的HCl的质量,利用
 ×100%计算该稀盐酸的质量分数;根据实验数据,前三次所加入的稀盐酸都完全发生了反应,在计算稀盐酸的溶质质量分数时可使用前三次的实验数据.
×100%计算该稀盐酸的质量分数;根据实验数据,前三次所加入的稀盐酸都完全发生了反应,在计算稀盐酸的溶质质量分数时可使用前三次的实验数据.点评:根据反应进行参加反应的溶液溶质质量分数计算时,一定要选取溶液中溶质完全反应时的数据计算溶液中溶质的质量,这样求得的溶质质量才是溶液中全部溶质的质量.

练习册系列答案
相关题目
石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如表:
(1)计算该石灰石样品中碳酸钙的质量分数.
(2)计算该20g稀盐酸中含有HCl的质量.(精确到0.01)
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | 1g | 1g |
(2)计算该20g稀盐酸中含有HCl的质量.(精确到0.01)
石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
(1)该石灰石样品中碳酸钙的质量分数是 ;
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%).
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | 1g | 1g |
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%).
根据下图所示装置回答问题:
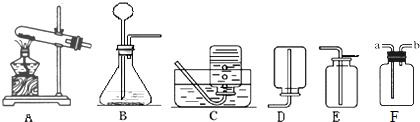
(1)实验室用大理石和稀盐酸反应制取二氧化碳,应选用的装置是 ,请写出该反应的化学方程式: .
(2)实验室用A装置加热高锰酸钾来制取氧气,需要改进的是 ,反应的化学方程式为 .下列反应可使用A装置进行实验的是(填序号) .
①过氧化氢溶液和二氧化锰制氧气; ②一氧化碳还原氧化铁; ③木炭还原氧化铜
(3)装置F可用来收集气体,还具有其他用途,如在F瓶中装入 ,可用来干燥某些气体.若用F收集氧气并测量制得氧气的体积,需在瓶内先装满水,气体从 (填“a”或“b”)处导管通入,并需要补充的一种玻璃仪器是 .
(4)石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
试计算该稀盐酸的溶质质量分数.

(1)实验室用大理石和稀盐酸反应制取二氧化碳,应选用的装置是
(2)实验室用A装置加热高锰酸钾来制取氧气,需要改进的是
①过氧化氢溶液和二氧化锰制氧气; ②一氧化碳还原氧化铁; ③木炭还原氧化铜
(3)装置F可用来收集气体,还具有其他用途,如在F瓶中装入
(4)石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | l g | 1g |