题目内容
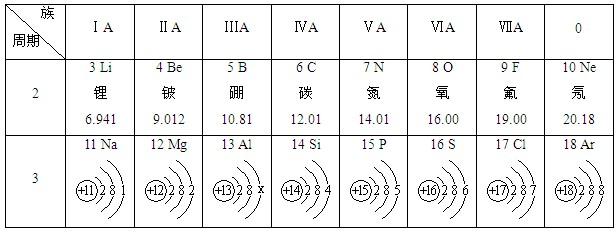
如表是元素周期表中第三周期元素,回答下列问题:
| 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(2)原子序数为12和17形成的化合物的化学式为______,这种化合物是由______(填“分子”、“原子”或“离子”)构成.
(3)在同一周期(横行)中,除0族(最右纵行)外,从左到右原子序数依次增多,原子半径逐渐减小;在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.原子半径:铝______硫(填“>”或“=”或“<”,下同),原子得电子能力:磷______氯.
(4)钠是一种非常活泼的金属,常温下能与水剧烈反应,放出大量热,使自身熔化成小球,生成氢气和一种碱,该反应的化学方程式为______.
解:(1)地壳中含量最多的金属元素是铝,从表中查出铝的相对原子质量为26.98.
(2)从表中可以查出,原子序数为12和17的元素分别为镁和氯,这两种元素的化合价分别为+2和-1,形成的化合物的化学式为MgCl2,氯化镁是由离子构成的.
(3)在同一周期(横行)中,从左到右原子序数依次增多,原子半径逐渐减小;在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.因此原子半径:铝>硫,原子得电子能力:磷<氯.
(4)根据题中信息和质量守恒定律可知,钠和水在常温下反应,生成氢气和氢氧化钠,该反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
故答案为:(1)26.98;(2)MgCl2;离子;(3)>;<;(4)2Na+2H2O=2NaOH+H2↑.
分析:(1)根据地壳中含量最多的金属元素是铝和元素周期表提供的信息进行解答.
(2)根据元素周期表可以查出元素的名称,然后根据元素的化合价书写化合物的化学式即可.
(3)根据提供的信息:同一周期,元素原子半径从左到右半径逐渐减小,得电子能力逐渐增强分析.
(4)根据提供的信息结合化学方程式的书写分析.
点评:本题考查学生对元素周期表知识的理解与掌握,并能在解题中灵活应用的能力.
(2)从表中可以查出,原子序数为12和17的元素分别为镁和氯,这两种元素的化合价分别为+2和-1,形成的化合物的化学式为MgCl2,氯化镁是由离子构成的.
(3)在同一周期(横行)中,从左到右原子序数依次增多,原子半径逐渐减小;在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.因此原子半径:铝>硫,原子得电子能力:磷<氯.
(4)根据题中信息和质量守恒定律可知,钠和水在常温下反应,生成氢气和氢氧化钠,该反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
故答案为:(1)26.98;(2)MgCl2;离子;(3)>;<;(4)2Na+2H2O=2NaOH+H2↑.
分析:(1)根据地壳中含量最多的金属元素是铝和元素周期表提供的信息进行解答.
(2)根据元素周期表可以查出元素的名称,然后根据元素的化合价书写化合物的化学式即可.
(3)根据提供的信息:同一周期,元素原子半径从左到右半径逐渐减小,得电子能力逐渐增强分析.
(4)根据提供的信息结合化学方程式的书写分析.
点评:本题考查学生对元素周期表知识的理解与掌握,并能在解题中灵活应用的能力.

练习册系列答案
相关题目
如表是元素周期表中的一部分,请按表中信息填空:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | 3Li 锂 6.941 | 4Be 铍 9.012 | 5B 硼 10.81 | 6C 碳 12.01 | 7N 氮 14.01 | 8O 氧 16.00 | 9F 氟 19.00 | 10Ne 氖 20.18 |
| 3 | 11Na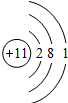 | 12Mg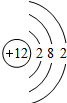 | 13Al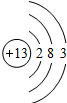 | 14Si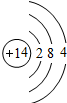 | 15P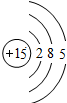 | 16S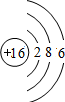 | 17Cl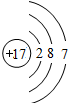 | 18Ar |
(2)表中的x=______,该元素属第______周期,属______元素(填“金属”或“非金属”);
(3)写出原子序数3和17的元素组成的物质的化学式______;
(4)从表中可初步推断,原子结构与族之间的关系是______.