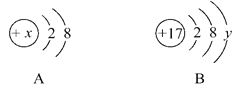题目内容
【题目】(1)已知在相同温度和相同压强的条件下,相同体积的任何气体都含有相同数目的分子。在上述条件下,测得1体积甲气体(分子式X4)和6体积乙气体(分子式Y2)完全反应生成了4体积丙气体。则丙的分子式为__________。
(2)6 g某物质在氧气中完全燃烧,生成4.4 g二氧化碳和3.6 g水,试推测该物质的元素组成___________________________________________________。
(3)碳酸氢钠用于焙制糕点,在270 ℃时分解:2NaHCO3Na2CO3+H2O↑+CO2↑。现取NaHCO316.8 g,在敞口容器中加热到质量不再改变为止,减少的质量为____。
【答案】 XY3 C、H、O 6.2 g
【解析】(1)在相同温度和相同压强的条件下,相同体积的任何气体都含有相同数目的分子,所以1体积甲气体(化学式X4)和6体积乙气体(化学式Y2)完全反应生成了4体积丙气体,它们的分子个数比为1:6:4,设丙的化学式为M,因此该反应可写为X4+6Y2=4M,反应物中X的个数是4个、Y的个数是12个,M的前面系数是4,根据质量守恒定律可知丙的化学式为XY3; (2)根据化学反应前后元素的种类和元素的质量不变,4.4g二氧化碳中含碳元素的质量为: ![]() ;3.6gH2O中含氢元素的质量为:
;3.6gH2O中含氢元素的质量为: ![]() ;1.2g+0.4g=1.6g<6g,所以该物质中含有:碳元素、氢元素、氧元素;(3)设反应生成碳酸钠的质量为
;1.2g+0.4g=1.6g<6g,所以该物质中含有:碳元素、氢元素、氧元素;(3)设反应生成碳酸钠的质量为![]()
![]()
![]()
![]()
168 106
16.8g ![]()
![]()
解得: ![]() =10.6g
=10.6g
则减少的质量=16.8-10.6g=6.2g。

【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如图所示的pH曲线,请回答: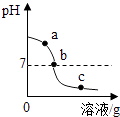
(1)由图可知该实验操作是将滴加到另一种溶液中;
(2)该反应的化学方程式为;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl.
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液. | 该样品为b处溶液. | |
该样品为c处溶液,并推知溶液中的阳离子有 . |
(4)【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑 .