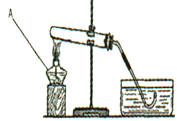
题目内容
已知铜可以和浓硝酸发生如下反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑,实验室可以通过该反应制取二氧化氮气体。NO2是一种红棕色气体,密度比空气大,能和水反应。NO和NO2都是空气的污染物。现给出下列装置: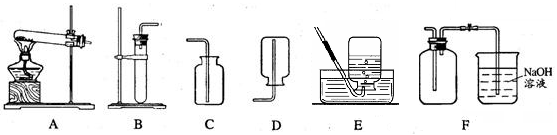
(1)某同学做该实验时,有失去标签的浓硝酸和浓盐酸,如何区分出浓硝酸?
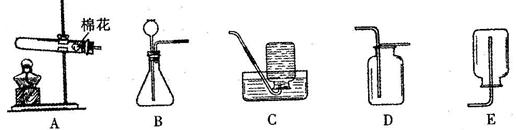
(2)制取NO2的发生和收集装置应分别选用 和 。请写出利用你选择的发生装置制取另一种气体的反应方程式。
(3)随着反应的进行能产生NO气体,请解释可能的原因?
(4)已知NO密度比空气略大,难溶于水,NO能与氧气反应生成NO2,应选用装置 收集NO,并写出NO和氧气反应的化学方程式。
(5)某同学做完实验后,为回收废液中的金属铜,向废液中加入28g铁屑,恰好完全反应。请计算回收到的铜的质量。
(1)装在棕色瓶里的是浓硝酸
(2)B F 2H2O2MnO22H2O+O2↑或CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
(3)随着浓盐酸消耗和水的生产,浓硝酸变稀,铜与稀硝酸反应产生NO
(4)E 2NO + O2 = 2NO2 (5)32g
解析

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
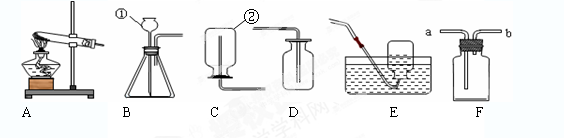
某研究性学习小组利用下列装置进行气体的制取实验,请回答下列问题。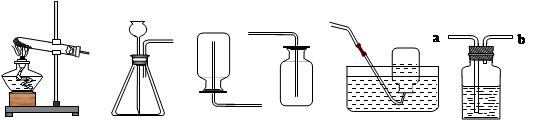
|
(1)选用A装置制取氧气的化学方程式 。制取气体时,组装好仪器后,应先 ,再添加药品;使用F装置排空气法收集氧气,气体应从 端通入(填“a”或“b”)。
(2)A、E连接,制取的氧气不纯的原因是 (写一点即可)。
(3)实验室制取二氧化碳选择的发生装置和收集装置是 (填选项字母),选择该发生装置的依据是 ,检验二氧化碳是否收集满的方法是 。
(4)若用F装置检验制得的气体是否为二氧化碳,则F装置内应放入的物质是 ,气体应从 端通入(填“a”或“b”)现象是 。