题目内容
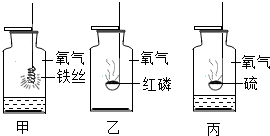
如下图所示,有三种不同的实验装置,集气瓶中均充满空气,燃烧匙内所盛有的物质(装置一中物质为红磷:装置二中物质为木炭;装置三中分别装有红磷和木炭)均为过量,大烧杯内盛有水.当充分燃烧后,冷却至室温,打开弹簧夹:
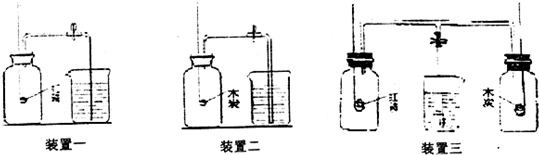
打开止水夹:请依次描述,打开止水夹后三种装置所出现的现象及其原因:
(1)装置一中所出现的现象为
(2)装置二中所出现的现象为
(3)装置三中所出现的现象为

打开止水夹:请依次描述,打开止水夹后三种装置所出现的现象及其原因:
(1)装置一中所出现的现象为
水倒流入集气瓶中且约占集气瓶容积的
| 1 |
| 5 |
水倒流入集气瓶中且约占集气瓶容积的
,原因是| 1 |
| 5 |
红磷燃烧消耗了氧气,生成的五氧化二磷是固体,瓶内气压减小
红磷燃烧消耗了氧气,生成的五氧化二磷是固体,瓶内气压减小
;(2)装置二中所出现的现象为
水不倒流
水不倒流
,原因是木炭燃烧消耗了氧气,生成了二氧化碳.且生成的二氧化碳的体积等于消耗掉的氧气的体积,瓶内气压不变
木炭燃烧消耗了氧气,生成了二氧化碳.且生成的二氧化碳的体积等于消耗掉的氧气的体积,瓶内气压不变
;(3)装置三中所出现的现象为
水倒流入左瓶中.
水倒流入左瓶中.
.分析:只有熟悉用红磷燃烧的方法测定空气中氧气含量实验的原理、操作、现象、结论、注意事项等问题,才能作出正确的答案.
解答:解:装置一瓶中红磷燃烧消耗了氧气,生成的五氧化二磷是固体,瓶内气压减小,因此水在外界大气压的作用下流入甲瓶.
装置二瓶中木炭燃烧消耗了氧气,生成了二氧化碳.且生成的二氧化碳的体积等于消耗掉的氧气的体积,因此瓶内气压不变,水不会流入瓶内.
装置三中红磷燃烧消耗了氧气,瓶内气压减小;木炭燃烧消耗了氧气,生成了二氧化碳.且生成的二氧化碳的体积等于消耗掉的氧气的体积,因此瓶内气压不变,当打开止水夹时,水流入左瓶中.
故答案为:(1)水倒流入集气瓶中且约占集气瓶容积的
,红磷燃烧消耗了氧气,生成的五氧化二磷是固体,瓶内气压减小;
(2)水不倒流,木炭燃烧消耗了氧气,生成了二氧化碳.且生成的二氧化碳的体积等于消耗掉的氧气的体积,瓶内气压不变;
(3)水倒流入左瓶中..
装置二瓶中木炭燃烧消耗了氧气,生成了二氧化碳.且生成的二氧化碳的体积等于消耗掉的氧气的体积,因此瓶内气压不变,水不会流入瓶内.
装置三中红磷燃烧消耗了氧气,瓶内气压减小;木炭燃烧消耗了氧气,生成了二氧化碳.且生成的二氧化碳的体积等于消耗掉的氧气的体积,因此瓶内气压不变,当打开止水夹时,水流入左瓶中.
故答案为:(1)水倒流入集气瓶中且约占集气瓶容积的
| 1 |
| 5 |
(2)水不倒流,木炭燃烧消耗了氧气,生成了二氧化碳.且生成的二氧化碳的体积等于消耗掉的氧气的体积,瓶内气压不变;
(3)水倒流入左瓶中..
点评:本题主要考查红磷燃烧的方法测定空气中氧气含量实验的原理、操作、现象、结论、注意事项等问题,难度稍大

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
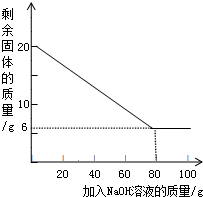 某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数.
某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数.【查阅资料】
(1)氢氧化镁和氢氧化铝据难溶于水.难溶碱受热后能分解生成水和相应的金属氧化物.
(2)镁和氢氧化镁均不能与氢氧化钠溶液反应,但铝和氢氧化铝均能能与氢氧化钠溶液发生如下反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al(OH)3+NaOH=NaAlO2+2H2O
【方案设计】他们利用实验室提供的盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金
| ||
方案二:铝镁合金
| ||
方案三:铝镁合金
| ||
| ||
【方案评价】
1)三个方案是否均可行,如有不可行的请说明理由.
2)如果你是小组成员,你愿意采用何种方案?
【实验设计】实验小组根据方案二设计了如下图所示(图中的铁架台已省略)的两个实验装置.
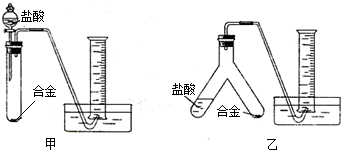
你认为选择
【交流讨论】
(1)小组成员实验后,通过交流讨论普遍认为上述三个实验方案均存在操作不够简便或容易产生测量误差的问题.于是按照上述形式重新设计了方案,请你帮助他们完成新方案的设计(在→上方填写相应的试剂和操作):
2)小组成员按照新的测定方案,取20g铝镁合金,研成金属粉末后,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
(2)分析以上数据可知,上表中n的值为
(3)该金属粉末中Al的质量分数为
(4)列式计算:所用氢氧化钠溶液的溶质质量分数为多少?计算过程:
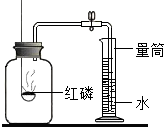 经测定,集气瓶的容积为250mL,在此实验中,观察到量筒中减少的水的体积为50mL,则空气中氧气的体积分数为
经测定,集气瓶的容积为250mL,在此实验中,观察到量筒中减少的水的体积为50mL,则空气中氧气的体积分数为


 经测定,集气瓶的容积为250ml,在此实验中,观察到量筒中减少的水的体积为50ml,则空气中氧气的体积分数为______.实验需保证整个装置不漏气且所用红磷必须足量,如果实验时未冷却到室温便打开弹簧夹观察量筒内减少的水的体积,则实验结果将(填偏大、偏小或不变)______.实验完毕后,集气瓶内残余的气体主要是______(填化学符号).若将上述实验中的红磷换成木炭(其他不变)进行实验,并未发现倒吸现象,其原因是______.
经测定,集气瓶的容积为250ml,在此实验中,观察到量筒中减少的水的体积为50ml,则空气中氧气的体积分数为______.实验需保证整个装置不漏气且所用红磷必须足量,如果实验时未冷却到室温便打开弹簧夹观察量筒内减少的水的体积,则实验结果将(填偏大、偏小或不变)______.实验完毕后,集气瓶内残余的气体主要是______(填化学符号).若将上述实验中的红磷换成木炭(其他不变)进行实验,并未发现倒吸现象,其原因是______.