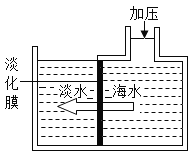
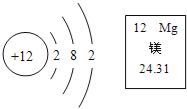
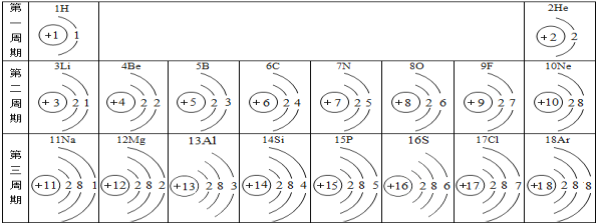
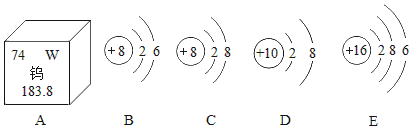
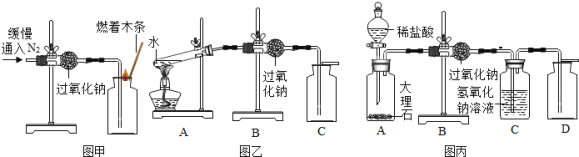
��Ŀ����
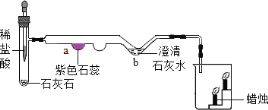
����Ŀ��������ͼ��װ�ã��Ը������Ϊ��Ӧ���ȡһƿ���������顣ʵ�������С���Ը�������� ����ȫ��Ӧ�������ɻ�����ʦ�����£�С����ȡһ��������ʣ���ĩ����������ʵ�飬������ʵ������ ���ݻ�������ͼ����ʾ�����ߡ�

��1��С����ʵ���֪�������δ��ȫ��Ӧ��������_____��
��2����ͼ���л������������淴Ӧʱ��仯������_____��
��3������ʣ���ĩ�и�����ص�����������_____��д��������̣���������ȷ�� 0.1%��
���𰸡�����ʣ������ĩ���������ݲ���������ȹ��壬����������С�� 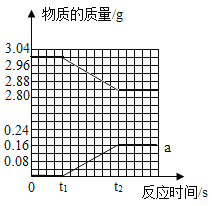 52.7%
52.7%
��������
���ݵ��ܿ�������ð������֪�������δ��ȫ��Ӧ������������������������Ӧԭͼ�ɻ�����ʣ���ĩ�и�����ص���������Ϊʣ����������ԭ������ص������ȡ�
��1������ʣ������ĩ���������ݲ���������ȹ��壬����������С����
��2����������������Ϊ3g-2.84g=0.16g����t1��ʼ��t2������������0����0.16g��Ȼ���������仯���������Ϊͼ��a�� ��
��
��3���⣺��ʣ���ĩ�и�����ص�����Ϊx��
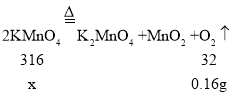
![]()
x=1.58g��
������ص���������=![]() ��100%��52.7%��
��100%��52.7%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�