题目内容
过氧化氢的水溶液俗称双氧水,在放置过程中会缓慢分解.现有一瓶未曾使用过的、久置的双氧水,瓶上商品标签提供了如下信息:①H2O2的质量分数为30%; ②内装溶液质量1000g.经实验测定,其中H2O2的质量分数现仅为10%. 请计算:
(1)若用这瓶双氧水来配制3%的医用双氧水1500g,需用这种双氧水的质量是多少?
(2)计算这瓶双氧水中已分解的过氧化氢的质量.
【答案】
【解析】
试题分析:(1)设所需这种双氧水的质量为x,则x×10%=1 500 g×3%,解得:X=450g;(2)设这瓶双氧水变质过程中减少的过氧化氢的质量为y
2H2O2 2H2O+O2↑
2H2O+O2↑
68 32
y

余下溶质H2O2的质量为300g﹣y,余下溶液的质量为1000g﹣ .
.
再根据变质后溶液中溶质的质量分数为10%列出等式:
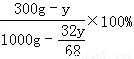 =10% 解得:y=209.9g
=10% 解得:y=209.9g
答:(1)若用这瓶双氧水来配制3%的医用双氧水1500g,需用这种双氧水的质量是450g(2)计算这瓶双氧水中已分解的过氧化氢的质量是209.9g.
考点:根据化学反应方程式的计算.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
过氧化氢的水溶液俗称双氧水,在放置过程中会缓慢分解.某100g30%的双氧水放置一段时间后,经实验测定其溶质质量分数变为25%,则分解掉的过氧化氢的质量是( )
| A、5g | B、5.3g | C、5.67g | D、6.56g |