题目内容
【题目】如图是A、B、C三种固体物质在水中的溶解度曲线图,请回答下列问题: 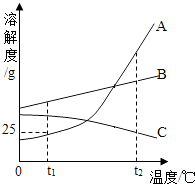
(1)t1℃时A物质的溶解度是克.
(2)当A物质中混有少量B物质吋,通常可采用的方法提纯A物质.
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃后(升温过程中溶剂的质量不变),三种溶液中溶质的质量分数由大到小的顺序是(填字母).
【答案】
(1)25
(2)降温结晶
(3)B>C>A
【解析】解:(1)据图可以看出,t1℃时A物质的溶解度是25g,故填:25;(2)A物质的溶解度随温度的升高变化大,当A物质中混有少量B物质吋,通常可采用降温结晶的方法提纯A物质,故填:降温结晶;(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃后,AB的溶解度随温度的升高而增大,故溶液组成不变,溶质质量分数与t1℃相同,且是B大于A,C的溶解度随温度的升高而减小,会析出固体,据图可以看出,C的溶质质量分数大于A,故三种溶液中溶质的质量分数由大到小的顺序是B>C>A,故填:B>C>A.
根据已有的溶解度曲线的意义进行分析解答,交点表示在同一温度下两种物质的溶解度相等,可以比较同一温度下两种物质的溶解度的大小,根据溶解度随温度的变化特点确定析出晶体的方法,根据溶质质量分数进行比较即可.

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】实验室想探究影响化学反应因素,设计如下方案,请完成如表,回答相关问题:
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
实验Ⅰ | 探究温度对H2O2分解速率的影响 | 25℃ | 1g氧化铁 | 10mL 5%的H2O2溶液 |
实验Ⅱ | 45℃ | 2g二氧化锰 | 10mL 6%的H2O2溶液 |
(1)结果实验Ⅱ的反应速率更快,很多同学一致认为温度越高,过氧化氢溶液分解越快,但王老师认为他们的实验方案设计不完全正确,请你找出该实验不恰当的地方是(请说出2点)、 .
(2)若用5g二氧化锰跟氯酸钾混合加热制取9.6g的氧气,至少需要多少克的氯酸钾?反应结束后残留固体质量至少有多少?(请利用化学方程式计算,并写出解题过程)





