题目内容
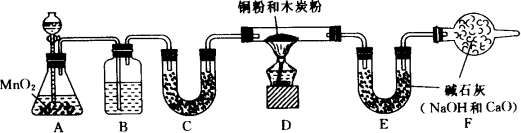
为了测定一包均匀混合的铜粉和炭粉的混合物中铜的质量分数,某化学课外小组的同学们设计了如图所示的实验(实验装置的气密性良好,图中铁架台等仪器均已略去).他们利用了30%的双氧水与二氧化锰作用制取实验中所需的氧气,反应的化学方程式是2H2O2![]() 2H2O+O2↑,请回答下列有关问题:
2H2O+O2↑,请回答下列有关问题:
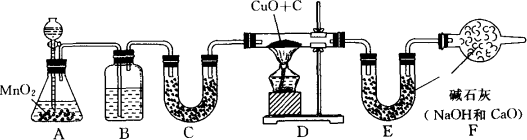
(1)装置B中所盛放的试剂是________,作用是________;C中所盛放的试剂是________,作用是________;
(2)装置F的作用是________;
(3)已知硬质玻璃管内装有铜粉和炭粉的混合物6 g,反应完全(氧气过量),停止加热并冷却至室温后,称得E装置增加了3.3 g,则样品中铜的质量分数为________;
(4)实验完成后,老师让学生自我评价,如果没有B、C、F装置,实验测得的铜的质量分数将________(填“偏大”或“偏小”).
答案:
解析:
解析:
|
答案:(1)浓硫酸;除去O2中可能含有的水蒸气;无水硫酸铜;检验O2中的水蒸气是否完全被除去 (2)防止空气中的水蒸气和二氧化碳进入E装置 (3)85%[提示:根据E装置增重3.3 g,说明生成CO2的质量为3.3 g,根据反应的化学方程式C+O2 (4)偏小[提示:如果没有B、C、F装置,则E装置增重将大于3.3 g,碳的质量将大于0.9 g,则混合物中Cu的质量将小于5.1 g,所以,铜的质量分数将小于85%] 分析:这是一道有关氧气制法、气体干燥、计算等的综合实验题. |

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目