题目内容
某学习小组的三位同学为测定镀锌铁皮的锌镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)
(1)甲同学的方案是先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度.在实际操作中,甲同学的方案存在一个很大的问题是______.
(2)乙同学是通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:
足量5%盐酸①过量氢氧化钠②镀锌铁皮金属全部溶解沉淀Fe2O3固体③烘干、灼烧④配制5%的盐酸1L(ρ=1.025g/cm3),需取用36.5%(ρ=1.181g/cm3)的盐酸______mL(保留一位小数).配制过程中用到的玻璃仪器,除烧杯外,还有______.步骤③的操作是______.
若使用的镀锌铁皮的质量为28.156g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.10cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为______.
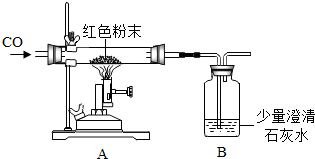
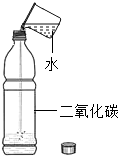
(3)丙同学的方案是通过如图所示装置,测量镀锌铁皮与强酸反应产生气体的质量来计算锌层的厚度.己知镀锌铁皮质量为18.200g,加入稀硫酸质量为140g,则稀硫酸的质量百分比浓度至少应大于______.若改用浓盐酸,则测出锌的厚度会______(填“偏大”、“偏小”、或“无影响”).
(4)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢?______.原因是______.
(1)甲同学的方案是先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度.在实际操作中,甲同学的方案存在一个很大的问题是______.
(2)乙同学是通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:
足量5%盐酸①过量氢氧化钠②镀锌铁皮金属全部溶解沉淀Fe2O3固体③烘干、灼烧④配制5%的盐酸1L(ρ=1.025g/cm3),需取用36.5%(ρ=1.181g/cm3)的盐酸______mL(保留一位小数).配制过程中用到的玻璃仪器,除烧杯外,还有______.步骤③的操作是______.
若使用的镀锌铁皮的质量为28.156g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.10cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为______.
(3)丙同学的方案是通过如图所示装置,测量镀锌铁皮与强酸反应产生气体的质量来计算锌层的厚度.己知镀锌铁皮质量为18.200g,加入稀硫酸质量为140g,则稀硫酸的质量百分比浓度至少应大于______.若改用浓盐酸,则测出锌的厚度会______(填“偏大”、“偏小”、或“无影响”).
(4)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢?______.原因是______.

(1)由于铁也会与盐酸反应产生氢气,因此很难判断什么时候锌正好反应掉而铁没有反应;
(2)设需取用36.5%(ρ=1.181g/cm3)的盐酸的质量为x
5%×1L×1.025g/cm3=36.5%×x
x=140.4g
盐酸的体积=
=118.9mL
由题意知40.000g为氧化铁的质量,所以铁的质量=40.000g×
×100%=28.000g
所以锌的质量=28.156g-28.000g=0.156g
设锌层的厚度为y
则0.156g=5.10cm×5.00cm×y×2×7.14g/cm3,
y=0.000428cm=4.28μm
配制过程中用到的玻璃仪器,除烧杯外,还有量筒、玻璃棒.步骤③的操作是洗涤.
(3)根据同质量的锌和铁反应消耗硫酸的质量,铁消耗硫酸的质量多,所以假设18.200g全部是铁,设消耗硫酸的质量分数为z
Fe+H2SO4=FeSO4+H2↑.
56 98
18.20g 140g×z
=
z=22.75%
若改用浓盐酸,因为浓盐酸具有挥发性,会使得测的气体的质量偏大,所以导致锌的质量偏大,所以测出锌的厚度会偏大;
(4)锌和铁的原子量差异不大,镀锌铁皮中两者的比例的改变造成与酸反应后产生氢气质量的改变非常微小,对称量的要求很高.另外在实验的过程中随着气体的产生也会带走水蒸气,造成实验结果的不可靠,所以乙同学的测量方案更加可靠.
故答案为:
(1)由于铁也会与盐酸反应产生氢气,因此很难判断什么时候锌正好反应掉而铁没有反应.
(2)118.9;量筒、玻璃棒;洗涤(1分);4.28μm.
(3)22.75%;偏大.
(4)乙同学;锌和铁的原子量差异不大,镀锌铁皮中两者的比例的改变造成与酸反应后产生氢气质量的改变非常微小,对称量的要求很高.另外在实验的过程中随着气体的产生也会带走水蒸气,造成实验结果的不可靠.
(2)设需取用36.5%(ρ=1.181g/cm3)的盐酸的质量为x
5%×1L×1.025g/cm3=36.5%×x
x=140.4g
盐酸的体积=
| 140.4g |
| 1.181g/cm3 |
由题意知40.000g为氧化铁的质量,所以铁的质量=40.000g×
| 56×2 |
| 56×2+16×3 |
所以锌的质量=28.156g-28.000g=0.156g
设锌层的厚度为y
则0.156g=5.10cm×5.00cm×y×2×7.14g/cm3,
y=0.000428cm=4.28μm
配制过程中用到的玻璃仪器,除烧杯外,还有量筒、玻璃棒.步骤③的操作是洗涤.
(3)根据同质量的锌和铁反应消耗硫酸的质量,铁消耗硫酸的质量多,所以假设18.200g全部是铁,设消耗硫酸的质量分数为z
Fe+H2SO4=FeSO4+H2↑.
56 98
18.20g 140g×z
| 56 |
| 18.20g |
| 98 |
| 140g×z |
z=22.75%
若改用浓盐酸,因为浓盐酸具有挥发性,会使得测的气体的质量偏大,所以导致锌的质量偏大,所以测出锌的厚度会偏大;
(4)锌和铁的原子量差异不大,镀锌铁皮中两者的比例的改变造成与酸反应后产生氢气质量的改变非常微小,对称量的要求很高.另外在实验的过程中随着气体的产生也会带走水蒸气,造成实验结果的不可靠,所以乙同学的测量方案更加可靠.
故答案为:
(1)由于铁也会与盐酸反应产生氢气,因此很难判断什么时候锌正好反应掉而铁没有反应.
(2)118.9;量筒、玻璃棒;洗涤(1分);4.28μm.
(3)22.75%;偏大.
(4)乙同学;锌和铁的原子量差异不大,镀锌铁皮中两者的比例的改变造成与酸反应后产生氢气质量的改变非常微小,对称量的要求很高.另外在实验的过程中随着气体的产生也会带走水蒸气,造成实验结果的不可靠.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目