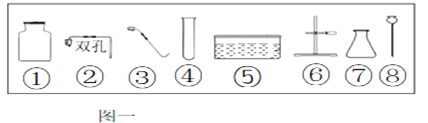
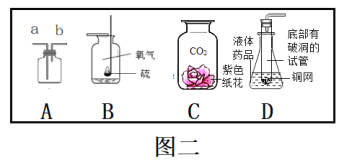
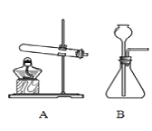
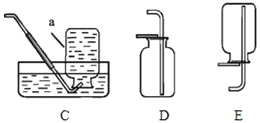
题目内容
【题目】某化工厂排放的废液中只含有ZnCl2和CuCl2两种溶质,为回收金属Cu并得到ZnCl2固体,化学小组的同学们设计并进行了如下实验

(1)滤液I中的溶质是_____________________________;
(2)B中含有的物质是_____________________________;
(3)操作③名称是_________________________________。
(4) 操作①中的反应为_____________________________________________。
【答案】氯化锌 铜和锌 蒸发结晶 Zn+CuCl2=ZnCl2+Cu
【解析】
滤液1和滤液2能得到氯化锌固体,说明滤液1、2中的的溶质是氯化锌,说明加入的过量物质A是锌,将滤渣B与过量的稀盐酸反应,能得到铜,气体C,和氯化锌溶液,说明滤渣B中含有铜和锌,气体C是氢气。
(1)有以上分析可知,滤液1中的溶质是氯化锌;
(2)滤渣B中的物质是铜和锌。
(3)操作3是将溶质从溶液中析出,故是蒸发结晶。
(4)滤液1中的溶质是氯化锌,说明废液中的溶质是氯化铜,操作1发生的反应是氯化铜与锌反应生成铜和氯化锌,方程式为:Zn+CuCl2=ZnCl2+Cu

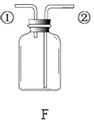
【题目】根据图中实验装置,回答问题:
发生装置 | 收集装置 | 洗气装置 |
|
|
|
(1)仪器a的名称是__.
(2)实验室用高锰酸钾制取氧气,装置A还需做的改进是__________;实验室用过氧化氢溶液制取氧气,可用的发生装置是_______(选字母,下同);若用F装置收集二氧化碳,则气体应从F装置的___(填“①”或“②”)端口通入;检验CO2的化学方程式为___________。
(3)通过查阅资料得知:氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水,可用加热氯化铵和氢氧化钙的固体混合物制取。如果要制取氨气你应选择的发生装置是___________和收集装置是________。