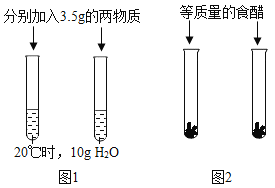
��Ŀ����
����Ŀ����Ϊ��˾��Ϊ�ҹ����¿Ƽ��Ĵ�����һֱ�����ں��ļ������з������������Ƶ���������оƬ�Ѵﵽ��������ˮƽ����оƬ����Ҫ����Ϊ�ߴ��ȵĵ��ʹ衣��ش���������йص�����:

��1����ͼ�ǹ�Ԫ����Ԫ�����ڱ��е��й���Ϣ����ԭ�ӽṹʾ��ͼ����Ԫ������_______�����������������ǽ�������Ԫ�أ��裨Si��ԭ�ӵ����������___�����ӣ�������ԭ������Ϊ________���裨Si��ԭ����̼ԭ�ӵ�������������ȣ�ԭ�ӽṹ���ơ�����ݶ�����̼�Ļ�ѧʽ��д�����������Ļ�ѧʽ_______��
��2����ҵ���ƴֹ�ԭ��:����������̼�����ڸ������������ɵ��ʹ��һ�ֿ�ȼ���������ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ: _____________________________��
��3����ҵ��ȡ�ߴ���IJ��ַ�Ӧԭ������ʾ��ͼ����:

�÷�Ӧ�Ļ�ѧ����ʽΪ _____________________����Ӧ���Ԫ�ػ��ϼ�______��ѡ��������������������������������
���𰸡��ǽ��� 4 28.09 SiO2 SiO2+2C![]() Si+2CO
Si+2CO![]() SiCl4+2H2
SiCl4+2H2![]() Si+4HCl ����
Si+4HCl ����
��������
(1)������ʯ���ԣ����ڷǽ���������д���ǽ�����
��ͼ��֪����ԭ�ӵ����������4�����ӣ�����д��4��
��ͼ��֪��������ԭ������Ϊ28.09������д��28.09��
��ԭ����̼ԭ�ӵ�������������ȣ�ԭ�ӽṹ���ƣ�������̼�Ļ�ѧʽΪCO2����ˣ����������Ļ�ѧʽΪSiO2������д��SiO2��
(2)����������̼�����ڸ������������ɵ��ʹ��һ����̼������д��SiO2+2C![]() Si+2CO
Si+2CO![]() ��
��
(3)��ͼ��֪���Ļ�ѧʽΪSiCl4���ҵĻ�ѧʽΪH2�����Ļ�ѧʽΪSi�����������غ㶨�ɵ���ʵ�ʣ���ѧ��Ӧ��ǰ��ԭ�Ӹ�����ԭ��������ԭ���֪��X�Ļ�ѧʽΪ��HCl������д��SiCl4+2H2![]() Si+4HCl��
Si+4HCl��
�ɻ�ѧ����ʽ�ɵã���Ӧ�����Ȼ����й�Ԫ�صĻ��ϼ�Ϊ+4����������й�Ԫ�صĻ��ϼ�Ϊ0����Ӧ���Ԫ�ػ��ϼ۽��ͣ�����д�����͡�

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�����Ŀ��ij����ˮ�к�����������Ϊ4.9%��H2SO4�����кͺ�����ŷţ�ij��ȤС��ͬѧ�������ۣ�����������кͷ����������Լ��ļ۸����£�
�к��Լ� | �������� | �������� |
�۸�/��Ԫ����1�� | 800 | 450 |
��1����Ӿ��������Ƕ�˵��ѡ���������Ƶ����ɣ�
��_____����_____��
��2����ͬѧ�����ð�ˮ�����кͣ����Ի���һ�ֻ��ʣ��仯ѧʽΪ_____���÷�ˮ��������Ļ���������_____��ѡ���ţ���
A �ؽ�����Ⱦ B �ж�������Ⱦ C ��Ӫ������Ⱦ D ��������Ⱦ